Julius Lothar Meyer
(1830-1895)
A kémiai elemek természete atomsúlyaik
függvényében
Részletek
Annalen der Chemie, Supplementband 7, 354–364 (1870)
(in: Henry Marshall Leicester and Herbert S. Klickstein, A
Source Book in Chemistry 1400-1900 (Harvard University Press, Cambridge,
Massachusetts, 1963)
 Az atomsúlyokban
mutatkozó szabályszerûségeket nemcsak nagyon
különbözõ elemek között keresik az egyes
szerzõk, hanem igen eltérõen mutatják is be.
Miután meggondolásainkat nem Gmelin úgynevezett "ekvivalenseire"
alapozzuk, hanem az Avogadro, valamint Dulong
és Petit szabályai alapján meghatározott
atomsúlyokat használjuk, ezeknek a szabályszerûségeknek
a bemutatása jelentõsen egyszerûsödik. Már
1864-ben találtam olyan szabályszerûségeket,
amelyek az addig különbözõnek tekintett kémiai
elemcsaládokat ugyanabba a rendszerbe sorolták. Az atomsúlyok
pontos meghatározása révén azóta a mostanáig
felfedezett, kellõképpen ismert elemek is bekerülhettek
ebbe a rendszerbe. Nemrégiben Mengyelejev mutatta
meg, hogy ilyen elrendezés elõállítható,
ha az összes elem atomsúlyát, mindenféle önkényes
válogatás nélkül, egyszerûen nagyságuk
szerint egyetlen sorba rakjuk, a sort részekre osztjuk, s a részeket
változatlan sorrendben fûzzük össze. A következõ
táblázat lényegében azonos a Mengyelejevével.
Az atomsúlyokban
mutatkozó szabályszerûségeket nemcsak nagyon
különbözõ elemek között keresik az egyes
szerzõk, hanem igen eltérõen mutatják is be.
Miután meggondolásainkat nem Gmelin úgynevezett "ekvivalenseire"
alapozzuk, hanem az Avogadro, valamint Dulong
és Petit szabályai alapján meghatározott
atomsúlyokat használjuk, ezeknek a szabályszerûségeknek
a bemutatása jelentõsen egyszerûsödik. Már
1864-ben találtam olyan szabályszerûségeket,
amelyek az addig különbözõnek tekintett kémiai
elemcsaládokat ugyanabba a rendszerbe sorolták. Az atomsúlyok
pontos meghatározása révén azóta a mostanáig
felfedezett, kellõképpen ismert elemek is bekerülhettek
ebbe a rendszerbe. Nemrégiben Mengyelejev mutatta
meg, hogy ilyen elrendezés elõállítható,
ha az összes elem atomsúlyát, mindenféle önkényes
válogatás nélkül, egyszerûen nagyságuk
szerint egyetlen sorba rakjuk, a sort részekre osztjuk, s a részeket
változatlan sorrendben fûzzük össze. A következõ
táblázat lényegében azonos a Mengyelejevével.
| I. |
II. |
III. |
IV. |
V. |
VI. |
VII. |
VIII. |
IX. |
|
B=11,0 |
Al=27,3 |
-- |
-- |
|
?In=113,4 |
|
Tl=202.7 |
|
C=11,97 |
Si=28 |
|
-- |
|
Sn=117,8 |
|
Pb=206,4 |
|
|
|
Ti=48 |
|
Zr=89,7 |
|
-- |
|
N=14,01 |
P=30,9 |
|
As=74,9 |
|
Sb=122,1 |
|
Bi=207,5 |
|
|
|
V=51,2 |
|
Nb=93,7 |
|
Ta=182,2 |
|
O=15,96 |
S=31,98 |
|
Se=78 |
|
Te=128? |
|
|
|
|
|
Cr=52,4 |
|
Mo=95,6 |
|
W=183,5 |
|
F=19,1 |
Cl=35,38 |
|
Br=79,75 |
|
I=126,5 |
|
|
|
|
|
Mn=54,8 |
|
Ru=103,5 |
|
Os=198,6? |
|
|
|
Fe=55,9 |
|
Rh=104,1 |
|
Ir=196,7 |
|
|
|
Co&Ni=58,6 |
|
Pd=106,2 |
|
Pt=196,7 |
| Li=7,01 |
Na=22,99 |
K=39,04 |
|
Rb=85,2 |
|
Cs=132,7 |
|
|
|
|
|
Cu=63,3 |
|
Ag=107,66 |
|
Au=196,2 |
| ?Be=9,3 |
Mg=23,9 |
Ca=39,9 |
|
Sr=87,0 |
|
Ba=136,8 |
|
|
|
|
|
Zn=64,9 |
|
Cd=111,6 |
|
Hg=199,8 |
A táblázat minden olyan elemet tartalmaz, amelynek atomsúlyát
vagy vegyületeinek gõzsûrûségei, vagy hõkapacitása
alapján eddig meghatározták. Az elemek növekvõ
atomsúlyaik szerint követik egymást. Csak a rendellenesnek
tekinthetõ hidrogén hiányzik a sorból. A táblázatban
szerepel a Be és az In is, amelyek valószínû
atomsúlyai ekvivalens súlyaikból származnak.
A táblázat összesen 56 elemet tartalmaz. A H mellett
mindössze az Y, Eb, (Tb?), Ce, La, Di, Th, U, Jg (jargónium)*
hiányzik, ezek egyikének sem ismert az atomsúlya,
és néhányuknak még az egyenértéksúlya
sem ismert. Ezek az elemek késõbb, legalább részben,
valószínûleg betöltik majd a táblázat
üres helyeit. Egyes helyeket talán az ezután felfedezendõ
elemek töltenek majd be. Az is elõforduhat, hogy az új
felfedezések nyomán egyik vagy másik elem elkerül
a helyérõl, és egy megfelelõbb kerül oda.
Az elemek a kilenc függõleges oszlopban molekulasúlyaik
szerint követik egymást, míg a vízszintes sorok
a természetes családokat tartalmazzák. Ehhez az elrendezéshez
néhány elemet, amelynek atomsúlya csaknem egyenlõ
s talán nem is áll rendelkezésre kellõ pontossággal,
kissé át kellett helyezni, így került a tellúr
a jód elé, az ozmium az iridium és a platina elé
és ezek az arany elé. Késõbbi kutatásoknak
kell eldönteniük, hogy ez a fordított sorrend megfelel-e
a pontos atomsúlyoknak. Egyetlen észrevétellel egészítem
ki azokat a megjegyzéseket, amelyeket Mengyelejev fûzött
a táblázatához: a IV, VI és VIII függõleges
oszlopban álló elemek gyakran izomorf kapcsolatban állnak
az elõzõ vízszintes sorban lévõ elemekkel,
tehát a Ti és Zr a Si-mal, a V a P-ral, a Cr és Mo
a S-nel, a Mn a Cl-ral, az Ag a Na-mal, a Zn a Mg-mal stb. Ami az atomokat
illeti – melyeket eddig még nem bontottak részekre –, a táblázat
egyszerû és nagyon fontos következményre vezet.
Ha feltételezzük, hogy az atomok ugyanannak az anyagnak az
aggregátumai, és csak eltérõ tömegeik
miatt különböznek egymástól, akkor az elemek
tulajdonságait atomsúlyaik függvényének
tekinthetjük; úgy tûnik, hogy atomsúlyaik közvetlen
függvényei. A táblázat arra utal, hogy az elemek
tulajdonságai jórészt atomsúlyaik
periodikus
függvényei. Ugyanolyan vagy hasonló tulajdonságok
jelennek meg ismét, ha az atomsúly egy bizonyos értéket
elér, 16 egység után, körülbelül 46,
végül 88–92 egység után. Ez minden esetben igaz,
akármelyik elembõl indulunk ki. De bármilyen meglepõ
és érdekes is ez a megfigyelés, teljes sötétségben
hagy bennünket a tulajdonságok periódusokon belüli
változását illetõen, mert a periódusok
elején észlelt tulajdonságok a periódusok végén
megismétlõdnek. Ha például a Li-tól
indulunk ki, mintegy 16 egységnyi növekedés után
azt tapasztaljuk, hogy lényegében ugyanazok a tulajdonságok
jelennek meg a Na-ban, és ismét 16 egység után
a K-ban. Ugyanakkor igen változatos sort mutat a Be, B, C, N, O,
F, majd a Mg, Al, Si, P, S, Cl; mindössze az atomok telítési
kapacitása nõ és csökken szabályosan mindkét
esetben.
Egy
vegyért. |
Két
vegyért. |
Három
vegyért. |
Négy
vegyért. |
Három
vegyért. |
Két
vegyért. |
Egy
vegyért. |
| Li |
Be |
B |
C |
N |
O |
F |
| Na |
Mg |
Al |
Si |
P |
S |
Cl |
De ha az elemek természetét atomsúlyaik függvényében
óhajtjuk leírni, minden tulajdonság változását
elemrõl elemre, lépésenként kell követnünk.
A következõ gondolatmenet célja a vizsgálat kiindulási
pontjának meghatározása.
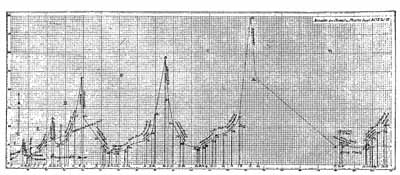 Az atomsúllyal
szabályosan változó tulajdonságok egyike az
elemek atomtérfogata. A táblázat grafikusan szemlélteti
ezt a változást az atomsúly-változás
függvényében. Az atomsúlyok az abszcissza mentén
változnak, az ordinátaértékek az elemek szilárd
állapotbeli atomtérfogataira utalnak (a klóré
kivételével, ahol az atomtérfogat a folyadékállapotra
vonatkozik); tehát az atomsúlyok és a sûrûségek
hányadosai vannak arányosan ábrázolva. A hidrogén
atomsúlya és a víz sûrûsége egységnyi.
Az egymást követõ ordinátapontokat folytonos
vonal köti össze, hogy még jobban látszódjék,
hogyan változnak az atomtérfogatok az atomsúly függvényében.
Ahol egy vagy több elem atomtérfogata ismeretlen, pontozott
vonal szerepel, és ezeknek az elemeknél az értékeket
dõlt betûk jelölik.
Az atomsúllyal
szabályosan változó tulajdonságok egyike az
elemek atomtérfogata. A táblázat grafikusan szemlélteti
ezt a változást az atomsúly-változás
függvényében. Az atomsúlyok az abszcissza mentén
változnak, az ordinátaértékek az elemek szilárd
állapotbeli atomtérfogataira utalnak (a klóré
kivételével, ahol az atomtérfogat a folyadékállapotra
vonatkozik); tehát az atomsúlyok és a sûrûségek
hányadosai vannak arányosan ábrázolva. A hidrogén
atomsúlya és a víz sûrûsége egységnyi.
Az egymást követõ ordinátapontokat folytonos
vonal köti össze, hogy még jobban látszódjék,
hogyan változnak az atomtérfogatok az atomsúly függvényében.
Ahol egy vagy több elem atomtérfogata ismeretlen, pontozott
vonal szerepel, és ezeknek az elemeknél az értékeket
dõlt betûk jelölik.
A görbe menetébõl látható, hogy az
elemek atomtérfogata, a kémiai tulajdonságokhoz hasonlóan,
atomsúlyaik periodikus függvénye.
Megjegyzés:
* H. C. Sorby 1869-ben – spektroszkópiai adatok
alapján – bejelentette, hogy a ceyloni jargon ásványból
új elemet vont ki, a jargóniumot. Egy évvel késõbb
visszavonta bejelentését. Az elemnek tulajdonított
spektrumvonalak szennyezett cirkóniumtól származtak.
| Vissza |
http://www.kfki.hu/chemonet/
http://www.ch.bme.hu/chemonet/ |
 Az atomsúlyokban
mutatkozó szabályszerûségeket nemcsak nagyon
különbözõ elemek között keresik az egyes
szerzõk, hanem igen eltérõen mutatják is be.
Miután meggondolásainkat nem Gmelin úgynevezett "ekvivalenseire"
alapozzuk, hanem az Avogadro, valamint Dulong
és Petit szabályai alapján meghatározott
atomsúlyokat használjuk, ezeknek a szabályszerûségeknek
a bemutatása jelentõsen egyszerûsödik. Már
1864-ben találtam olyan szabályszerûségeket,
amelyek az addig különbözõnek tekintett kémiai
elemcsaládokat ugyanabba a rendszerbe sorolták. Az atomsúlyok
pontos meghatározása révén azóta a mostanáig
felfedezett, kellõképpen ismert elemek is bekerülhettek
ebbe a rendszerbe. Nemrégiben Mengyelejev mutatta
meg, hogy ilyen elrendezés elõállítható,
ha az összes elem atomsúlyát, mindenféle önkényes
válogatás nélkül, egyszerûen nagyságuk
szerint egyetlen sorba rakjuk, a sort részekre osztjuk, s a részeket
változatlan sorrendben fûzzük össze. A következõ
táblázat lényegében azonos a Mengyelejevével.
Az atomsúlyokban
mutatkozó szabályszerûségeket nemcsak nagyon
különbözõ elemek között keresik az egyes
szerzõk, hanem igen eltérõen mutatják is be.
Miután meggondolásainkat nem Gmelin úgynevezett "ekvivalenseire"
alapozzuk, hanem az Avogadro, valamint Dulong
és Petit szabályai alapján meghatározott
atomsúlyokat használjuk, ezeknek a szabályszerûségeknek
a bemutatása jelentõsen egyszerûsödik. Már
1864-ben találtam olyan szabályszerûségeket,
amelyek az addig különbözõnek tekintett kémiai
elemcsaládokat ugyanabba a rendszerbe sorolták. Az atomsúlyok
pontos meghatározása révén azóta a mostanáig
felfedezett, kellõképpen ismert elemek is bekerülhettek
ebbe a rendszerbe. Nemrégiben Mengyelejev mutatta
meg, hogy ilyen elrendezés elõállítható,
ha az összes elem atomsúlyát, mindenféle önkényes
válogatás nélkül, egyszerûen nagyságuk
szerint egyetlen sorba rakjuk, a sort részekre osztjuk, s a részeket
változatlan sorrendben fûzzük össze. A következõ
táblázat lényegében azonos a Mengyelejevével.
 Az atomsúllyal
szabályosan változó tulajdonságok egyike az
elemek atomtérfogata. A táblázat grafikusan szemlélteti
ezt a változást az atomsúly-változás
függvényében. Az atomsúlyok az abszcissza mentén
változnak, az ordinátaértékek az elemek szilárd
állapotbeli atomtérfogataira utalnak (a klóré
kivételével, ahol az atomtérfogat a folyadékállapotra
vonatkozik); tehát az atomsúlyok és a sûrûségek
hányadosai vannak arányosan ábrázolva. A hidrogén
atomsúlya és a víz sûrûsége egységnyi.
Az egymást követõ ordinátapontokat folytonos
vonal köti össze, hogy még jobban látszódjék,
hogyan változnak az atomtérfogatok az atomsúly függvényében.
Ahol egy vagy több elem atomtérfogata ismeretlen, pontozott
vonal szerepel, és ezeknek az elemeknél az értékeket
dõlt betûk jelölik.
Az atomsúllyal
szabályosan változó tulajdonságok egyike az
elemek atomtérfogata. A táblázat grafikusan szemlélteti
ezt a változást az atomsúly-változás
függvényében. Az atomsúlyok az abszcissza mentén
változnak, az ordinátaértékek az elemek szilárd
állapotbeli atomtérfogataira utalnak (a klóré
kivételével, ahol az atomtérfogat a folyadékállapotra
vonatkozik); tehát az atomsúlyok és a sûrûségek
hányadosai vannak arányosan ábrázolva. A hidrogén
atomsúlya és a víz sûrûsége egységnyi.
Az egymást követõ ordinátapontokat folytonos
vonal köti össze, hogy még jobban látszódjék,
hogyan változnak az atomtérfogatok az atomsúly függvényében.
Ahol egy vagy több elem atomtérfogata ismeretlen, pontozott
vonal szerepel, és ezeknek az elemeknél az értékeket
dõlt betûk jelölik.