A fordítás E. W. Warnhoff írása alapján készült (The curiously intertwined histories of benzene and cyclohexane, Journal of Chemical Education, 1996., 73. k., 6. sz., 494–496. o.), a JCE engedélyével. A Journal of Chemical Education lapjai a http://jchemed.chem.wisc.edu/ címen érhetõk el.
A szerves kémia tanulásakor a hallgatók elõbb ismerkednek meg a ciklohexánnal, mint a benzollal, mert a modern tankönyvek a benzol nevének említése elõtt tárgyalják a cikloalkánokat és a ciklohexán konformációját. A tankönyvírók a kémiatörténeti megközelítésnél jobb módszernek tartják a kémiai összefüggések logikus bemutatását. Rendszerint megemlítik, hogy a benzol 1825-ös felfedezése és a szerkezetére vonatkozó elsõ fontos hipotézis megjelenése között 40 év telt el. Érthetõ, ha a hallgatók elgondolkoznak azon, hogy a ciklohexánt ismerték-e a benzol szerkezetének megállapítása elõtt, és ha igen, miért nem alakították át a benzolt ciklohexánná a gyûrûs szerkezet bizonyítása érdekében. Hogy ez miért nem volt egyszerû feladat, a történések alapján érthetõ meg.
A benzol korai felfedezése és tisztítása
részben a vegyület kedvezõ fagyás- és
olvadáspontjának köszönhetõ (5,5, illetve
80 oC), részben annak a szerencsés körülménynek
tudható be, hogy a benzol a világítógáz
gyártásakor nemkívánatos melléktermékként
kondenzálódott (1). De a ciklohexánnak is hasonlóan
kedvezõ a fagyás- és olvadáspontja (6,5, illetve
80,7 oC)! Egyetlen természetes vagy ipari forrásból
sem tudták azonban könnyen kinyerni addig, amíg a XIX.
század végén meg nem indult a kõolaj rendszeres
vizsgálata, és csak 1894-ben publikáltak két
független ciklohexánszintézist – majdnem 30 évvel
azután, hogy Kekulé megírta híres dolgozatát
a benzolgyûrûrõl (2). A benzol és a ciklohexán
története mégis összefonódik, s ebben sok
híres XIX. századi vegyész – Berthelot, Baeyer, Markovnyikov,
Perkin Jr., Kisner és Zelinszkij – is szerepet játszik.
 |
 |
 |
 |
| M. Berthelot
(1827–1907) |
A. Baeyer
(1835–1917) |
W. H. Perkin, Jr.
(1860–1929) |
V. V. Markovnyikov
(1838–1904) |
Két évvel azután, hogy Kekulé felvetette a benzol gyûrûs szerkezetének gondolatát, 1867–1868-ban, Marcellin Berthelot, a párizsi Collège de France professzora, a szerves vegyületek redukálására bevezette méthode universelle-nek nevezett eljárását, amellyel bármely szerves vegyület legtelítettebb szénhidrogén analogonjává alakítható át (3,4). Akkoriban kevés redukciós módszert ismertek, általában valamilyen fémet alkalmaztak sav vagy alkohol jelenlétében, s az új, általános eljárás nagyon ígéretesnek tûnt.1 Berthelot az anyagot zárt üvegcsõben, füstölgõ hidrogén-jodid nagy feleslegével, több órán át hevítette 275–280 oC-on (3).2 Kísérletei során a benzolt is ilyen kezelésnek vetette alá (4). A benzol csaknem teljesen redukálódott; a termék összetétele, minden vizsgált tulajdonsága, forráspontja (69 oC) véleménye szerint megfelelt az n-hexánénak [korábbi nevein hexil-hidrid, hexilén-(di)hidrid vagy kapriolén-hidrid; forráspontja 68,5–70 oC], amelyet néhány évvel korábban Wanklyn és Erlenmeyer állított elõ (7), illetve Pelouze és Cahours vont ki amerikai kõolajból (8). Ugyanez a termék keletkezett a fenol redukciójakor is. Berthelot nem lepõdött meg a (számunkra elképesztõ) tökéletes redukción és gyûrûhasításon, hiszen nem fogadta el Kekulé szerkezeti elméletét és a benzol gyûrûs szerkezetének hipotézisét. Valójában nem hitt az atomelméletben, és a szerves vegyületek szerkezetére vonatkozó összes elméletet elutasította (9). Mivel a benzolt néhány évvel korábban acetilén hõkezelésével állította elõ (10), három acetilénmolekula "asszociációjának" tekintette, és nem tartotta rendkívülinek, hogy hexánná redukálódjék (9).
Azok a vegyészek, akik elfogadták a Kekulé-féle gyûrûs benzolszerkezetet, meglepõdtek az eredményen. Kekulé egyik tanítványa, a Berlinben dolgozó Adolf Baeyer, nem hitt a hexánképzõdésben, mert ehhez a feltételezett gyûrûnek fel kellett volna hasadnia. 1870-ben megismételte a kísérletet, és ugyanazt a terméket kapta, mint Berthelot, de a kb. 70 oC forráspontú szénhidrogént nem vizsgálta tovább (szakmai illendõségbõl talán?). Feltételezte azonban, hogy a termék az ismeretlen hexahidro-benzol [ciklohexán]3 lehet, amely esetleg nehezen különböztethetõ meg a hexántól (11). Több évi szünet után, amely valószínûleg a francia–porosz háború egyik következménye volt, egy szentpétervári vegyész, Felix Wreden, aki ugyancsak kétkedéssel fogadta Berthelot eredményét, benzollal, toluollal, izoxilollal [m-xilollal] és fenollal ismételte meg a hidrogén-jodidos reakciót. Eredményeit 1877-ben közölte (14). A benzolból és a fenolból kapott termék valóban 69 oC körül forrt, de mind a négy vegyület redukciós terméke megfelelt a CnH2n képletnek. Wreden – Berthelot-val ellentétben – arra a következtetésre jutott, hogy az aromás vegyületek nem vehetnek föl hatnál több hidrogénatomot a hidrogén-jodidból. Berthelot, aki rosszul tûrte a bírálatot, válaszcikkében részletesen leírta Wredennek a kísérlet pontos lépéseit:
Az általam használt kísérleti körülmények igen nehezen valósíthatók meg ... de ismétlem, betartásuk roppant fontos. Ha Wreden úr pontosan dolgozik, minden eredményemet reprodukálhatja. ... Hevítse Wreden úr a szénhidrogénjét olajfürdõn, telített hidrogén-jodiddal, foszfor nélkül, 280 oC-on, 24 órán át, határozza meg a keletkezõ jódot a reakcióban kapott szénhidrogén elemzése mellett, és biztos vagyok benne, hogy elsõként ismeri fel a teljesen telített [CnH2n+2] szénhidrogén képzõdését (15).De talán Berthelot-ban is kétségek támadtak, mert 1877-ben újra redukálta a benzolt hidrogén-jodiddal (16). Bár köztitermékeket is kimutatott a reakció során, három egymást követõ kezelés után ugyanazt a szénhidrogén-frakciót kapta, mint korábban (forráspont 68,5–70 oC), a C,H-elemzés csaknem elfogadható határokon belül a C6H14 összetételre utalt, és a tulajdonságok megegyeztek a hexán tulajdonságaival. Berthelot tudta, hogy a hatszögû benzol hipotézisével az eredmény nehezen egyeztethetõ össze, de az õ teóriájával, a relatív telítések elméletével, amely a benzolt három acetilénmolekula asszociációjának tekintette, jól magyarázható. Ezek közül az acetilénmolekulák közül kettõt alárendeltnek tartott, és feltételezte, hogy négy hidrogénatom felvételére képesek (16).
Néhány évig nem foglalkoztak a benzol átalakulásának problémájával. Ezalatt elfogadták Kekulé gyûrûs szerkezeti képletét, megkezdték a hattagútól különbözõ gyûrûk kémiai vizsgálatát, és Baeyer kidolgozta a ciklikus szénvegyületek "feszülési elméletét" (17). Az újabb benzolvizsgálatok orosz laboratóriumokban indultak meg. A moszkvai egyetemen dolgozó Vlagyimir Markovnyikov 1890-ben arra a következtetésre jutott, hogy csak egyetlen C6H12 képletû ciklikus szénhidrogén létezhet,4 és a hexanaftén (kõolajból elõállított C6H12), a hexahidro-benzol (a benzol hidrogén-jodidos redukciójakor kapott C6H12), valamint a hexametilén (C6H12 gyûrûbe kapcsolódó hat metilénegység) azonos, de a feltevést meg kell alapozni (18). Korábban, 1888-ban, Markovnyikov és Spadi 69–70 oC forráspontú hexanaftént állított elõ ismételt frakcionált desztillációval a kaukázusi kõolajból (19). Markovnyikov moszkvai tanítványa, N. M. Kisner most hozzálátott, hogy Berthelot módszerével készítsen tiszta hexahidro-benzolt az összehasonlítás kedvéért. 1891-ben Kisner ugyanolyan forráspontú (69–71 oC) szénhidrogént kapott, mint Berthelot, amirõl elõször azt gondolta, hogy egy kevés hexánt tartalmazó hexahidro-benzol (20). A következõ évben ismét elõálította a vegyületet (fp.: 69–72 oC, 0 oC-os fajsúly 0,7539), és ezt már tiszta hexahidro-benzolnak tekintette (21). Négy laboratórium tehát (Berthelot, Baeyer, Wreden és Markovnyikov laboratóriuma) meg tudta ismételni a benzol hidrogén-jodidos redukcióját, de nem egyezett meg a hat szénatomos termék tisztaságát és szerkezetét illetõen. A múlt században még nehézséget jelentett a tisztítás és a tisztaság ellenõrzése, s a benzol szerkezetére vonatkozó különbözõ elképzelések sem kedveztek az egységes álláspont kialakításának. Az illékony telített szénhidrogének égéstermékeinek pontos elemzése sem volt könnyû feladat.
Markovnyikov hamarosan felfedezte, hogy hexanafténje legalább három szénhidrogén keveréke (22). Fontos momentum, hogy 1894-ben két különbözõ eljárást találtak az addig ismeretlen hexametilén [ciklohexán]3 elõállítására. Baeyer, aki akkor Münchenben élt, a ciklohexanol redukciójára dolgozott ki két variációt (1. ábra, 13, 23). Manchesterben Haworth és Perkin Jr. Wurtz-reakcióval szintetizálta és ciklizálta a hexametilén-dibromidot (2. ábra, 24, 25). A kétféle módszerrel elõállított hexametilén tulajdonságai megegyeztek (forráspontjaik is egyeztek a kísérleti hiba határain belül, az egyiké 79–79,5 oC, a másiké 77–80 oC volt), de ez a forráspont 10 oC-kal magasabbnak bizonyult, mint a hexahidro-benzolra és a hexanafténre kapott érték! A zavart jól érzékelteti, hogy Baeyer ennek alapján elfogadta, hogy Berthelot valóban hexánná redukálta a benzolt (23). Különben mi magyarázhatná Berthelot alacsonyabb forráspontját?
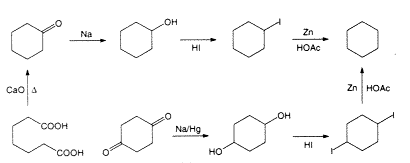
1. ábra. Baeyer ciklohexánszintézise
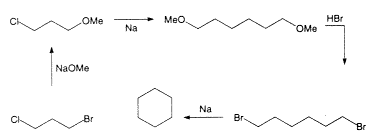
2. ábra. Perkin Jr. ciklohexánszintézise
Egy év múlva, a laboratóriumban szintetizált hexametilén forráspontjának ismeretében, Markovnyikov és Muravjev megmutatta, hogy a ciklohexán is megtalállható a természetben: a kaukázusi kõolaj gondos frakcionált desztillációjakor sikerült 78–80 oC forráspontú hexametilént [ciklohexánt] elõállítaniuk (22). Szerkezetét úgy állapították meg, hogy nitrálással szekunder nitrovegyületté alakították át, és ezt redukálták Baeyer hexametilén-aminjává [ciklohexil-aminjává].
Amikor nyilvánvalóvá vált, hogy a benzol hidrogén-jodidos redukciójakor keletkezõ hexahidro-benzol nem hexametilén (vagy hexán)5, Markovnyikov ennek az izomer szénhidrogénnek a valódi szerkezetét akarta feltárni. Konovalovval végül elõállították a tiszta állapotú, alacsonyabb forráspontú (71–72 oC), "hamis" hexanaftént a kaukázusi kõolaj frakcionált desztillációjának további finomításával, és kimutatták, hogy tulajdonságai megegyeznek a Kisner–Berthelot-féle hexahidro-benzol jellemzõivel (26). Az áttörésre 1894–1895-ben került sor, amikor Kisner6, Markovnyikov és Zelinszkij7 felismerte (26–28), hogy a "hexahidro-benzol"/hamis hexanaftén forráspontja nemcsak a hexánéval (68,5–70 oC), hanem a metil-cikopentánéval (70–71 oC) is megegyezik. Ezt a szénhidrogént Freer és Perkin Jr. néhány évvel korábban, 1888-ban 1,5-dibróm-hexán Wurtz-reakciójával állította elõ (31). Markovnyikov és Konovalov a metil-ciklopentánt most másképp, a b-metil-adipinsav ciklizációjával szintetizálta (3. ábra, 32), és azonosnak találta a "hexahidro-benzol"/hamis hexanafténnel. A nitrálás, majd a redukció tercier nitro- és aminovegyületekhez vezetett, amelyek különböztek a nitro- és amino-ciklohexántól (26). A szerkezet újabb bizonyítékaként a salétromsavas oxidáció nyomán glutársav és ecetsav keletkezett [a ciklohexánból fõként adipinsav képzõdik](33).
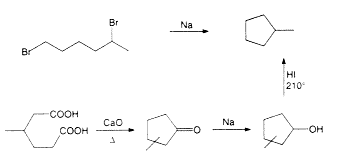
3. ábra. Perkin Jr. és Markovnyikov metil-ciklopentán-szintézise
A félreértések elkerülésére hangsúlyoznunk kell, hogy a hexahidro-benzol mibenlétét nem hirtelen felfedezték fel, nem egyszerûen a metil-ciklopentán forráspontjának megállapítása vezetett célhoz. Annak a felismerése, hogy a hexahidro-benzol azonos a metil-ciklopentánnal, az évek hosszú során át felhalmozódó tényeknek köszönhetõ. Markovnyikov 1890–1894-ben kimutatta, hogy a szuberonil-jodidból [cikloheptil-jodidból] két különbözõ szénhidrogén keletkezik (az egyik forráspontja 98–101 oC, a másiké 117–117,5 oC légköri nyomáson) attól függõen, hogy hidrogén-jodiddal redukálták-e 250 oC-on (34) vagy cinkkel és sósavval szobahõmérsékleten (35,36). A hidrogén-jodidos reakcióban keletkezõ, alacsonyabb forráspontú vegyületet metil-ciklohexánnak feleltették meg, mert bróm és alumínium-bromid hatására könnyen pentabróm-toluollá alakult át (35).8 A magasabb forráspontú szénhidrogénrõl, amely csak hosszas kezelés után alakult át pentabróm-toluollá (36), azt feltételezték, hogy heptametilén [cikloheptán]. A magas hõmérsékletû hidrogén-jodidos reakcióban lejátszódó átrendezõdés ötlete tehát már felvetõdött. Markovnyikov azt is megfigyelte, hogy a hexahidro-benzolból a bróm és az alumínium-bromid hatására nem a várt hexabróm-benzol, hanem ismeretlen vegyület keletkezik (37). Miután Kisner összehasonlította a tisztított hexahidro-benzol és a Baeyer-módszerrel elõállított hexametilén forráspontját, fajsúlyát és füstölgõ salétromsavval szembeni viselkedését,5 nemcsak arról gyõzõdött meg, hogy ezek különbözõ vegyületek (és nem ugyanannak a szénhidrogénnek különbözõ tisztaságú mintái), hanem érdekes analógiát tárt fel a két, szuberonil-jodidból származó szénhidrogénnel is (27). Mindkét pár alacsonyabb forráspontú szénhidrogénje volt a kisebb fajsúlyú, és ezek keletkeztek hidrogén-jodidos redukcióval. Mivel tudták, hogy a szuberonil pár alacsonyabb forráspontú vegyülete az átrendezõdött metil-ciklohexán, Kisner úgy gondolta, hogy a hexahidro-benzol nem lehet más, mint az átrendezõdött metil-ciklopentán (27).
Miután fényt derítettek arra, hogy a "hexahidro-benzol" a hidrogén-jodidos kezeléskor lejátszódó átrendezõdés terméke, az orosz vegyészek tovább folytatták a munkát. Kimutatták, hogy a ciklohexil-jodid, -klorid és -amin jórészt metil-ciklopentánná alakul át a hidrogén-jodid hatására magas hõmérsékleten (38, 39), míg a ciklohexán nem változik (40).9 Véleményük szerint a benzolból elõször ciklohexil-jodid képzõdött, amely átrendezõdött és metil-ciklopentánná alakult át (29). Ma már ismert, hogy a ciklohexil–metil-ciklopentil átrendezõdés, amelyet sokféle kísérleti körülmény között vizsgáltak, kationos (41, 42, 43) vagy gyökös folyamat (44,45) lehet.
Az a reakció tehát, amelyik nagyon egyszerû kémiai kapocs lehetett volna a benzol és a ciklohexán között, egy fel nem ismert átrendezõdés miatt 25 évig zsákutcába vezette a vegyészeket. A hexán és a metil-ciklopentán hasonló forráspontja, a kísérleti nehézségek és az ellentmodó elméletek "elfedték" az átrendezõdést. A benzolt csak ebben a században alakították át ciklohexánná egyszerû módon, hidrogénezéssel (46).
Jegyzetek
1. A katalitikus hidrogénezést csak 1900
után kezdték el.
2. A hidrogén-jodiddal már korábban
is redukáltak szerves vegyületeket. Lautemann 1860-ban, enyhébb
körülmények között, tejsavat redukált
propionsavvá (5), Schmidt pedig borkõsavat és
maleinsavat borostyánkõsavvá.
3. A ciklohexán elnevezést az
1892-es genfi konferencián javasolta Henry Armstrong (12).
Az új szót lassan fogadták el: a régi hexametilén
nevet még 1900 után is használták. Baeyer az
elsõk között vette át az új nevet 1893-ban
(13).
4. Markovnyikov – sok kortársához hasonlóan
– valószínûleg úgy gondolta, hogy csak a hattagú
gyûrû fordul elõ a természetben.
5. A hexahidro-benzol exoterm módon, tökéletesen
oldódott a füstölgõ salétromsavban, a hexán
és a hexametilén nem.
6. Kisner gondolt elõször erre a lehetõségre
(27),
s ezt Zelinszkij (28) és Markovnyikov is (29) elismerte.
7. A fiatal Zelinszkij ugyancsak a moszkvai egyetemen
dolgozott, és ugyanazt a témát választotta,
mint Markovnyikov, de nem tartotta fontosnak, hogy Markovnyikovot tájékoztassa
eredményeirõl. Lásd a (30) számú
hivatkozást.
8. Ezt a reagenst gyakran használták
brómozáson át vezetõ dehidrogénezésre,
dehidrobrómozásra és további brómozásra.
9. Kisner kétségbe vonta ezt az eredményt,
mert a jód eltávolítására amorf foszfort
használtak, holott a jódra szükség lehet a reakcióhoz
(33).
Irodalom
1. Faraday, M. (a) Phil. Trans. 1825, 115, 440-466; (b) Ann. Chim. 1825,
30, 269-291.
2. Kekulé, A. Ann. Chem. Pharm. 1865, 137, 129-196.
3. Berthelot, M. BuIl. Soc. Chim. Fr. 1867, /2/ 7, 53-65.
4. Berthelot, M. Bull. Soc. Chim. Fr. 1868, /2/ 9, 8-31.
5. Lautemann, E. Ann. Chem. Pharm. 1860, 113, 217-220.
6. Schmitt, R. Ann. Chem. Pharm. 1860, 114, 106-111.
7. Wanklyn, J. A.; Erlenmeyer, E. J. Chem. Soc. Trans. 1863, 16, 221-235.
8. Pelouze, J.; Cahours, A. Ann. Chem. Pharm. 1862, 124, 289-297.
9. Jacques, J. Berthelot–Autopsie d'un Mythe; Belin: Paris, 1987, pp
74-76, 195-208.
10. Berthelot, M. Compt. rend. Acad. Sci., Paris, 1866, 63, 479-484.
11. Baeyer, A. Ann. Chem. Pharm. 1870, 155, 266-281.
12. Armstrong, H. E. Proc. Chem. Soc. 1894, 8, 127-130.
13. Baeyer, A. Ber. Deut. chem. Ges. 1893, 26, 229-231.
14. Wreden, F. Liebigs Ann. Chem. 1877, 187, 153-167.
15. Berthelot, M. Bull. Soc. Chim. Fr. 1876, /2/ 26, 146-149.
16. Berthelot, M. Bull. Soc. Chim. Fr. 1877, /2/ 28, 497-502.
17. Baeyer, A. Ber, Deut. chem. Ges. 1885, 18, 2277-2281.
18. Markovnikov, V. V. Chem. Centralbl. 1890, 61-2, 242-243.
19. Spadi, I. V.; Markovnikov, V. V. J. Russ. phys. chem. Ges. 1888,
20, 118.
20. Kishner, N. M. Ber. Deut. chem. Ges. 1891, 24, Referate 559.
21. Kishner, M. M. Ber. Deut. chem. Ges. 1893, 26, Referate 96.
22. Markovnikov, V. V. ; Muravieff, I. T. Ber. Deut. chem. Ges. 1895,
28, 577-578.
23. Baeyer, A. Liebigs Ann. Chem. 1894, 278, 88-116.
24. Perkin Jr., W. H. Ber. Deut. chem. Ges. 1894, 27, 216-217.
25. Haworth, E.; Perkin Jr., W. H. J. Chem. Soc. Trans. 1894, 65. 591-602.
26. Markovnikov, V. V.; Konovalov, M. Ber. Deut. chem. Ges. 1895, 28,
1234-1237.
27. Kishner, N. M. J. Russ. phys. chem. Ges. 1894, 26 (Chem.), 375-380.
28. Zelinsky, N. D. Ber. Deut. chem. Ges. 1895, 28, 1022-1025.
29. Markovnikov, V. V. Liebigs Ann. Chem. 1898, 302, 1-42.
30. Markovnikov, V. V. Ber. Deut. chem. Ges. 1897, 30, 1211-1214.
31. Freer, P.C.; Perkin Jr., W. H. J. Chem. Soc. Trans. 1888, 53, 214-215.
32. Markovnikov, V. V.; Konovalov, M. Ber. Deut. chem. Ges. 1897, 30,
1214-1221.
33. Kishner, N. M. J. prakt. Chem. 1897, 56, 364-372.
34. Markovnikov, V. V. Ber. Deut. chem. Ges. 1890, 23, Referate 282.
35. Markovnikov, V. V. Ber. Deut. chem. Ges. 1892, 25, Referate 858.
36. Markovnikov, V. V. Ber. Deut. chem. Ges. 1894, 27, Referate 47.
37. Markovnikov, V. V. Ber. Deut. chem. Ges. 1892, 25, Referate 857.
38. Markovnikov, V. V. Ber. Deut. chem. Ges. 1897, 30, 1222-1226.
39. Zelinsky, N. D. Ber. Deut. chem. Ges. 1897, 30, 387-391.
40. Fortey, E. C. Chem. Centralbtatt, 1897, 2, 540.
41. Nenitzescu, C. D.; Cantuniari, I. P. Ber. Deut. chem. Ges. 1933,
66, 1097-1100.
42. Turova-Pollak, M. B.; Baranovskaya, N. B. J. Gen. Chem. (USSR),
1939, 9, 429-431.
43. Pines, H.; Aristoff, E.; Ipatieff, V. N. J. Amer. Chem. Soc. 1950,
72, 4055-4056.
44. Stein, S. E.; Rabinovitch, B. S. J. Phys. Chem. 1975, 79, 191-198.
45. Ondruschka, B.; Zimmermann, G.; Anders, G. J. prakt. Chem. 1984,
326 , 853-862.
46. Sabatier, P.; Senderens, J. B. Compt. rend. Acad. Sci., Paris 1901,
132, 210-212.