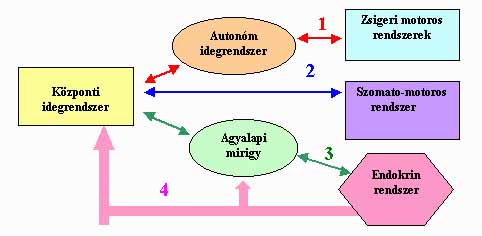
1. ábra. Neuromotoros (1,2) és neuroendokrin (3,4) szabályozás sémája.
Liposits Zsolt
Magyar Tudományos Akadémia, Kísérleti Orvostudományi Kutatóintézet, Neurobiológiai Osztály, Budapest
Összefoglalás
Szteroid hormonok termelésében az agyvelő, ivarmirigyek, mellékvesekéreg és a méhlepény vesz részt. A szteroidok a célsejtek membránján, a másodlagos hírvivő rendszereken és a sejtmagon keresztül fejtik ki hatásukat. A molekulákat specifikus receptorok észlelik, melyek a szteroid, pajzsmirigyhormon, retinsav, D3-vitamin magreceptorok közös családjába tartoznak. A szteroid receptorok különféle szerkezeti egységei szelektív, funkcionálisan összetett hatásokért felelősek. A ligand által aktivált receptor - serkentő és gátló hatású koregulátor molekulák közreműködésével - szabályozza a génátírás folyamatát. Az ösztrogén hormonok a szexuális differenciálódásért, a női ivarsejtek képződéséért, a reproduktív működés biztosításáért, valamint az idegszövet, csontszövet és az érrendszer fiziológiás szabályozásáért felelősek. A klasszikus ösztrogén receptor ismert génje mellett, Kuiper és munkatársai egy új típusú ösztrogén receptort kódoló mRNS-t klónoztak dülmirigy cDNS könyvtárból. Az új, béta típusú ösztrogén receptor (ERb) kiterjedt expressziót mutat több szervrendszerben, így a központi idegrendszerben, a keringés- és vázrendszerekben, valamint a reproduktív szisztéma szerveiben. A receptor expresszió változását kóros szövet burjánzással járó folyamatokban (emlő tumor, prosztata tumor, meningeoma) is megfigyelték.
Munkacsoportunk vizsgálatai a béta-típusú ösztrogén receptor közvetítésével végbemenő ösztrogén visszacsatolási és szabályozási mechanizmusok felderítésére irányulnak. Immuncitokémiai vizsgálataink a receptor domináns, sejtmagon belüli lokalizációjára utalnak. A receptor expresszió mértéke változó az egyes agyterületek, idegmagvak és a hormonális viszonyok függvényében. Elektronmikroszkópos vizsgálataink - a hypothalamus területén - a receptort a sejtmag kromatin állományához kötötten tárták fel. A hippokampális formáció és az agykéreg területén a dendritfa citoplazmájában is lokalizáltunk receptor immunreaktivitást. Észleletünk a receptor genomiális és nem-genomiális típusú szabályozásban egyaránt betöltött szerepére utal. Tanulmányozva az ERb-t szintetizáló idegsejtek kémiai jellegét, a paraventrikuláris és supraoptikus idegmagvakban oxytocint és vasopresszint termelő , míg az agykéregben kalciumkötő fehérjéket szintetizáló, gátló interneuronokban igazoltuk a receptor előfordulását. A reprodukciós ciklust vezénylő, luteinizáló hormon-releasing hormon (LHRH)-t termelő idegsejtek közel 80 %-ban mutattuk ki az ERb mRNS és ERb fehérje jelenlétét. Eredményeink elsőként igazolták, hogy az ösztrogén - genomiális szabályozó mechanizmus révén - közvetlenül is részt vehet az LHRH neuronok életfolyamatainak szabályozásában.
Transzgén egér (ERKO, BERKO, GFP-LHRH) és in vitro (GT1-7 sejtvonal, szövetszelet) modelleken folyamatban lévő vizsgálataink a receptor celluláris és molekuláris szintű működési mechanizmusát célozzák feltárni. Az ERb szelektív farmakonok remélt jövőbeli alkalmazása a gyógyászatban a csontritkulás, keringési elégtelenség és az érintett kognitív funkciók javítása terén hozzájárulhat az idős kor életminőségének javításához.
Bevezetés
Az élőlények működését a szervezetüket felépítő szervek és szervrendszerek együttműködése határozza meg. Az élettani funkciók biztosításának alapfeltétele a sejtek, szövetek és szervek között végbemenő folytonos kooperáció és kölcsönös szabályozás. A funkcionális egységek közti állandó információcsere fejlett kommunikációs mechanizmusokon alapul. Függetlenül a szervezeten belüli elhelyezkedésétől, méretétől és betöltött szerepkörétől, az adott elemi struktúra szabályozni kényszerül önmagát, közeli és távoli környezetének alkotóit, miközben homológ és heterológ struktúrákból érkező szabályozó jeleket fogad és integrál önmaga is. A kommunikáció során a sejtek egyrészt hírvivő jeleket generálnak és bocsátanak ki magukból, másrészt felkészültek szignálok fogadására, dekódolására és hasznosítására. A szignalizáció tartós mennyiségi avagy minőségi változása a szervezet belső egyensúlyának időleges vagy permanens felbomlását vonja maga után.
A külvilágból és a szervezetből eredő belső jelek feldolgozásában fontos szerepet játszik az idegrendszer. A jelbevitelt követően beinduló információ feldolgozás kimenő, parancs-jelek képződéséhez vezet. Utóbbiak két fő csatornát használnak a célstruktúrák szabályozására: a neuromotoros és a neuroendokrin rendszert (1. ábra). A neuromotoros szabályozás idegsejt láncolatok útján juttatja el a jelet a végső felhasználó struktúra számára, mely révén akaratlagos mozgás (szomato-motoros válasz) és/vagy zsigeri hatás (viscero-motoros válasz) valósul meg. A kommunikációs lánc elemei közti információ átadást bonyolult neurokémiai kódolási folyamatok eredményeként megszülető hírvivő anyagok (klasszikus neurotransszmitterek, neuropeptidek, gáz halmazállapotú anyagok, ionok) biztosítják. Az agyi vezérlés másik fő tengelye a neuroendokrin szabályozás, mely során a köztiagyban termelődő neurohormonok (releasing és inhibiting hormonok) az agyalapi mirigy szabályozása révén befolyásolják az endokrin szervek (pajzsmirigy, mellékvesekéreg, petefészek, here) hormon termelését, vagy közvetlenül a célszerveken hatnak. A szervek által termelt hormonok (pajzsmirigy-, mellékvesekéreg- és ivarmirigy hormonok) a véráram útján terjedve bejutnak szöveteinkbe, szerveinkbe és befolyásolják azok működését, beleértve az agyvelőt is.

1. ábra. Neuromotoros (1,2) és neuroendokrin (3,4) szabályozás sémája.
Vizsgáljuk meg az ideg- és endokrin rendszerek kölcsönhatását a belső elválasztású mirigyek által termelt szteroid hormonok esetében.
Szteroid hormonok és receptoraik
A szteroid vázas hormonok fő forrása a mellékvesekéreg, a petefészek, a here és - terhesség folyamán - a méhlepény. Az idegrendszerben termelődő hasonló kémiai szerkezetű hormonok a neuroszteroidok . A véráramba kiválasztott szteroid hormonok a célsejtekhez jutva átivódnak a sejthártyán. Gyors (másodperc-perc latencia idejű), nem-genomiális hatást az idegsejtek plazmamembránján fejtenek ki. Így a hippocampus idegsejtjeinek excitatorikus aminosav transzmitter anyagokra adott posztszinaptikus válaszát potenciálja az ösztradiol . A folyamat G protein- és protein kináz A-függő ciklikus AMP növekedést feltételez. Bár egyre több megfigyelés valószínűsíti a membránhoz kötött szteroid receptor létét, a felvetés igazolása további vizsgálatokat igényel. A szteroid molekulák klasszikus hatása specifikus szteroid receptorokon keresztül érvényesül, melyek a szteroid, pajzsmirigyhormon, retinsav, D3-vitamin és árva magreceptorok közös családjába tartoznak . A receptor fő funkcionális részeit az N-terminális modulátor egység (A,B), DNS-kötő és csukló egység (C,D) és a ligand-kötő (E, F) C terminális egység képezik (2. ábra). Mindhárom fő egység részt vesz a transzaktivációban, míg a nukleáris transzkripciót a DNS- és ligand-kötő alegységek szabályozzák. A dimerizációért és a heat shock protein (Hsp) kötésért a C-terminális rész a felelős. A ligand által aktivált receptorról disszociálnak a chaperone molekulák (HSP, 90 kDa, immunophilin Hsp 56), majd a homo- vagy heterodimert képző receptor-ligand komplex a sejtmagban palindrom DNS szekvenciához, az un. hormone response element (HRE)-hez kötődik (3. ábra).
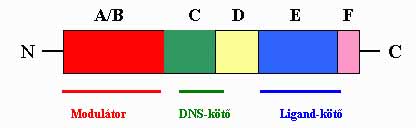
2. ábra. A szteroid receptor funkcionális alegységeinek sémája.
A genomiális hatás eléréséhez vagy a transzkripciós rendszer faktoraival történő közvetlen, avagy koregulátor anyagokkal (represszor, aktivátor) végbemenő közvetett interakciók szükségesek. Szemben a membrán hatásokkal , a genomiális hatás eléréséhez és beteljesedéséhez hosszabb időre van szükség (20-60 perc). Protein-protein és protein-DNS interakciók révén a szteroid receptorok további hatásokat képesek kifejteni a sejtek életfolyamatainak szabályozásában .
A receptorok sejten belüli lokalizációja változó képet mutat. Glukokortikoid és mineralokortikoid receptorok a ligand kötődését követően vándorolnak a citoplazmából a sejtmagba, szemben az ösztrogén, progeszteron és androgén receptorokkal, melyek többsége a sejtmagban fordul elő, függetlenül a receptor ligand általi telítettségétől.
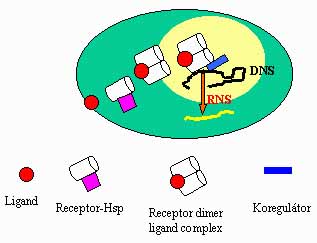
3. ábra. A szteroid receptor ligand általi aktiválásának sémás ábrázolása
Ösztrogén hormonok és receptoraik
Természetes ösztrogének és ösztrogén hatású anyagok
A ösztrogén hormonok (ösztradiol, ösztron és ösztriol) számos élettani folyamatot szabályoznak, így a korai szexuális differenciálódást, a másodlagos nemi jelleg kialakulását, a női ivarsejtek érését és a reprodukciós rendszer ciklikus működését. Az idegrendszeren hatva befolyásolják a szexuális magatartást és meghatározóak az idegszövet plaszticitásban. Továbbá, szabályozzák a váz és keringés rendszerek, valamint az anyagcsere szabályozás élettani folyamatait. Korábban női nemi hormonnak tartották, míg ki nem derült, hogy férfiakban is keletkezik tesztoszteronból 17ß-ösztradiol aromatizáció révén. Újkeletű észlelet, miszerint az agy is képes prekurzorokból neuroszteroidokat, köztük ösztrogént is előállítani.
Az ösztrogén hormonok mellett, számos egyéb nem-szteroidvázas anyag rendelkezik ösztrogén-szerű hatással. A xeno-ösztrogének közé sorolandók a szintetikus ösztrogének (dietilstilbösztrol), növényi eredetű anyagok (coumestrol, genistein, resveratrol), endokrin elváltozásokat okozó (disruptor) kemikáliák (DDT, bisphenol A) és a „szelektív ösztrogén receptor modulátor anyagok (SERM)” családja , melyek közül a humán gyógyászatban is sikerrel alkalmazott anti-ösztrogének, mint a tamoxifen (ösztrogén-függő emlő tumorok kezelése) és keoxifene (csontritkulás megelőzése) említendők. A legtöbb xeno-ösztrogén policiklusos vegyület, mely az ösztrogén váz A gyűrűjére emlékeztető fenolos gyűrűt hordoz. Hatásuk szövet specifikus, így egyes szövetekben agonista, míg másokban antagonista receptor ligandként viselkednek.
Ösztrogén receptorok
Az ösztrogén receptor felfedezése előtt mintegy három évtizeddel Flerkó és Szentágothai - petefészek szövetet implantálva a hypothalamus területére - bizonyították, hogy az idegsejtek képesek érzékelni az implantátumból felszabaduló ösztrogén hormonokat. A hormon recepció megváltoztatva az érintett hypothalamikus neuronok működését lecsökkentette az agyalapi mirigy gonadotróf hormon szekrécióját. Stumpf , valamint Pfaff úttörő munkásságának köszönhető az ösztrogént kötő idegmagvak és agyterületek feltérképezése, melyet triciált ösztradiol beadását követő autoradiográfiás vizsgálattal értek el 1968-ban. Az 1980-as évek közepétől, az ösztrogén receptor immuncitokémiai kimutatása az agyban lehetővé tette a célstruktúrák pontos azonosítását, az ösztrogén receptort hordozó idegsejtek finomszerkezeti vizsgálatát (4. ábra), a sejtek kemotípusának feltárását és afferens rendszereinek felderítését . Az ösztrogén receptor cDNS molekuláris klónozása és jellemzése a receptor mRNS eloszlását és feltérképezését célul tűző in situ hibridizációs vizsgálatok elvégzését tette lehetővé.
A multidiszciplináris vizsgálatok igazolták, hogy a receptor kiterjedt előfordulást mutat az agyban, jelentős reprezentációval a limbikus rendszerben, az endokrin szabályozó központokban és a zsigeri érző információkat feldolgozó struktúrákban.
A géntechnológiai eljárások fejlődése lehetővé tette az ösztrogén receptor hiányos (ERKO) egerek előállítását . A fenotípus fő jellemzői közé sorolandók a meddőség, degenerált petefészek, fokozott tumor gyakoriság a petefészekben, emlő atrófia, magas szérum ösztradiol szint, gonadotróf hormon alegység transzkriptumok emelkedett szintje, csökkent szexuális magatartás, fokozódó agresszivitás, csontnövekedés lassulása, valamint alacsony vaszkuláris nitrogén monoxid szint. Az ERKO egereken folytatott ösztrogén kötés vizsgálatok meglepő módon azt mutatták, hogy a transzgén egerek agyának mediális preoptikus területén a radioizotóppal jelölt ösztradiol továbbra is felvételre került. A jelenség egyik magyarázatául egy még ismeretlen ösztrogén receptor jelenléte szolgált. Ez a feltevés bizonyítást nyert miután Kuiper és munkatársai 1996-ban egy új típusú ösztrogén receptor cDNS sikeres klónozásáról számoltak be . Az újonnan felfedezett altípus az ösztrogén receptor béta (ERß) nevet kapta, míg a klasszikus receptort ösztrogén receptor alfa (ERa) néven különítjük el. Ismeretesek további nukleáris árva receptorok (estrogen receptor-related receptors), melyek az ösztrogén receptor DNS kötő szakaszával magas fokú homológiát mutatnak, ugyanakkor ligandjuk nem ismert. Feltehetően az ösztrogén-független transzkripciós szabályozásban töltenek be szerepet .
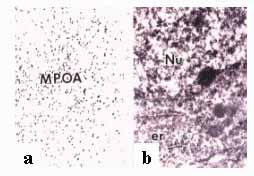
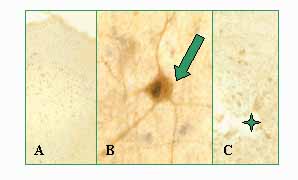
4. ábra. Ösztrogén receptor a immunreaktivitás patkány agy mediális preoptikus területén (MPOA). a. Immunjelölt idegsejtmagok fénymikroszkópos képe. b. Immunpozitív sejtmag (Nu) elektronmikroszkópos felvétele. er: ergasztoplazma. Kalló Imre anyagából.
A béta típusú ösztrogén receptor (ERb)
A receptor fő jellemzői
Az új ösztrogén receptort 1995 végén Gustafsson munkacsoportja klónozta patkány prosztata cDNS könyvtárából. Az ERb cDNS egy 484 aminosavból álló, 54,2 kDa molekulasúlyú fehérjét kódol. Felfedezését követően több speciesben klónozták a receptort és számos splice variánsát is leírták. Az a és b típusú ösztrogén receptorok különböző kromoszómák géntermékei. Jelentős homológia észlelhető a DNS-kötő (95%) és ligand-kötő (65%) helyek szerkezetében. Így nem meglepő, hogy az ismert ösztrogén ligandok relatív kötés-affinitása mindkét receptor esetében hasonló képet mutat . A növényi eredetű, ösztrogén hatással rendelkező anyagok ugyanakkor a béta-típusú receptorhoz vonzódnak jobban.
A receptor-DNS interakció folyamatában, a receptor aktivációját homodimer vagy a receptorral képzett heterodimer képződése jellemzi. Az aktivált receptor egyrészt a jól ismert DNS receptor kötőhelyeken - estrogen response element (ERE), electrophilic/antioxidant response elements - keresztül közvetlen, másrészt protein-protein interakciók (Sp1, AP1) révén közvetett módon vesz részt a transzkripció szabályozásában . A genomiális szabályozás mechanizmusában újonnan megismert, elemet képvisel a receptornak transzkripciós koregulátorokkal (aktivátorok, represszorok) történő együttműködése .
Ösztrogén receptorok aktiválása ösztrogén ligand nélkül is bekövetkezhet extracelluláris szignálok (peptid hormonok, neurotranszmitterek, növekedési faktorok, cytokinek), sejt foszforilációs regulátorok (PKA, PKC), valamint a sejt ciklust szabályozó anyagok hatására. A receptor foszforilációjáról nyert adatok elsősorban ERa-ra vonatkoznak és abban a mitogén-aktivált protein (MAP) kináz kiemelt szerepére utalnak.
Szemben az ERa knock-out egérrel, az ERb deficiens egerek neuroendokrin és reproduktív folyamatai kevésbé érintettek. A nőstények fertilisek, a gonadális tractus érzékeny ösztrogénre, ugyanakkor a petefészekben a tüszőérés frekvenciája csökkent. Az emlő fejlődése és differenciálódása zavartalan. Kettős knock-out állatok (abERKO) sterilitást mutatnak, az ováriumban a tüszők transzdifferenciációja mutatható ki a hímekre jellemző fenotipikus jegyek kialakulása mellett (Sertoli-szerű sejtek, Müller-féle gátló hormon expressziója) .
ERb előfordulása a szervezetben
Az alfa típusú receptorhoz hasonlóan, az ERb kiterjedt expressziót mutat a szervezetben. A két receptor előfordulásának biokémiai és anatómiai módszerekkel történő összehasonlítása számos közlemény tárgyát képezi . A szintézisből kitűnik, hogy különbség a szervrendszereket felépítő szervek és azok különböző sejt és szövetalkotói esetében adódik. Elsősorban a receptorok mennyiségi arányait és a különbségek funkcionális következményeit célszerű összevetni . A szervek vonatkozásában az ERb túlnyomó expressziója jellemzi a prosztatát, petefészket, tüdőt és húgyhólyagot. Továbbá, hímekben előfordul még a herében, mellékherében, ondómirigyben és az alsó húgyutakban. Nőstényekben a petefészek mellett az anyaméh és az emlő is termel ERb-t, ámbár az utóbbi két szerv esetében az ERa produkció jóval kifejezettebb. Mindkét nem esetében a központi idegrendszer, a csontrendszer és az érrendszer ERb termelése jelentős. Szöveti szinten érdemes elemezni a petefészket, melynek theca interna sejtjei ERa-t, míg a tüszőket felépítő granulosa hámsejtek ERb-t termelnek . A herében a fejlődő ivarsejtek és az érésüket segítő Sertoli-féle sejtek expresszálnak ERb-t. Az ösztrogén receptorok eltérő szerv és szövet specifikus eloszlása lehetővé teszi olyan gyógyszerek kifejlesztését és célzott alkalmazását, melyek elsősorban a célszerv receptorain keresztül hatnak, így ERb vonatkozásában reménykeltő az agy, csontrendszer és érrendszer szelektív befolyásolása ERb analógokkal, anélkül, hogy azok káros és nem kívánatos hatást fejtenének ki az a receptorban gazdag anyaméh és emlő szöveteiben.
Merchenthaler és munkacsoportja elsőként térképezte fel az ERb mRNS és fehérje eloszlását rágcsáló agyban . A szaglógumó, az agykéreg, a hippocampus és a kisagy területén az ERb típus az uralkodó. Más agyterületeken a két receptor keverten, olykor egyazon sejtben fordul elő. Az endokrin regulátor központ, a hypothalamus vonatkozásában említendő példák, miszerint a mediális preoptikus területen mindkét receptor előfordul, a magnocelluláris neuroszekretoros rendszer eredő sejtjeiben kizárólag ERb termelődik, míg az arcuatus és ventromediális idegmagvak életfolyamatait az ösztrogén az alfa altípusú receptoron keresztül szabályozza.
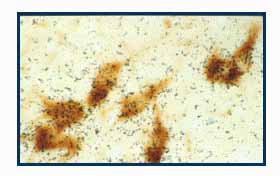
A b-típusú receptor jelenléte vagy expressziójának megváltozása tumoros folyamatokban is kimutatható. Az Országos Idegsebészeti Tudományos Intézettel folyó kollaboráció keretében, az ERb immunreaktivitás előfordulását mutattuk ki meningeoma és glioma (5. ábra) eseteiben.
5. ábra ERb immunreaktivitás kimutatása intakt (a,b) és kóros (b) humán agykérgi mintákban. A. Sejtmaghoz kötött immunjel az intakt kéregben. B. ERb immunreaktivitás calbindint szintetizáló kérgi interneuron (nyíl) magjában. C. Kapilláris (csillag) körül elhelyezkedő ERb-immunjelölt tumor sejtek gliomában.
A receptor immuncitokémiai kimutatása
Az első morfológiai közlemények az ERb mRNS kimutatásán alapultak . Később a receptor ellen számos ellenanyag készült, melyek közül több specificitása megkérdőjelezhető. Az általunk rágcsáló agy vizsgálatára használt szérummal elért immuncitokémiai térképezés eredménye megegyezik az ERb mRNS nyomon követésével nyert adatokkal . A legtöbb agyterületen a receptor tartalom az idegsejtek magjában mutatható ki, változó mennyiségben. Elektronmikroszkópos vizsgálataink a hypothalamus területén megerősítik a fénymikroszkópos eredményt, miszerint a receptor a sejtmag kromatin állományához kötötten fordul elő. Az észlelet támogatja a receptor genomiális szabályozásban való részvételét. A receptor mindkét nemben expresszálódik, az anteroventralis periventricularis mag területén szexuális dimorfizmus jelenségét mutatja . A receptor expresszióját a természetes ösztrogének és xeno-ösztrogének szövet-specifikus módon regulálják, így a paraventrikuláris mag területén az ösztradiol csökkenti, míg coumestrol fokozza az ERbb mRNS kifejeződését . A hypothalamikus neuroszekretoros rendszer oxytocint és vasopresszint termelő sejtjeiben végzett vizsgálataink feltárták , hogy a magnocelluláris idegsejtek ERb-t termelnek a paraventrikuláris és szupraoptikus magok területén egyaránt, az egyes almagok vonatkozásában eltérő arányban. Ugyanakkor, nevezett idegmagok alfa típusú receptort nem szintetizálnak patkányban. Az eredmények arra utalnak, hogy ösztrogének béta receptoron keresztül befolyásolják a só és vízháztartás, a szexuális és anyai magatartás, valamint a szoptatás és simaizom működés centrális, hypothalamikus szintű szabályozó folyamatait.
Érzékenyített immuncitokémiai eljárások alkalmazásával sikerült előkísérletekben az agykéreg és hippocampus területén az idegsejtek dendritfájában is kimutatnunk a b receptor jelenlétét. Az észlelet felveti a receptor szerepét sejtmagon kívüli nem-genomiális folyamatok szabályozásában.
6. ábra. ERb mRNS jelenlétét tükröző ezüstszemcsék tömörülése oxytocint termelő
idegsejtek felett a paraventrikuláris idegmag caudális részében. Immuncitokémiai és in situ hibridizációs módszerek ötvözése. Hrabovszky Erik anyagából.
A gonád működés centrális, ösztrogén hormonok általi szabályozása
Ösztrogén visszacsatolás, közvetett szabályozás
A hypothalamus-hypophysis-petefészek neuroendokrin tengely ciklusos működésének szabályozásában meghatározó a luteinizáló hormon-releasing hormon (LHRH)-t termelő idegsejtek szerepe, melyek patkány agyban a Broca-féle diagonális köteg mentén helyezkednek el a preoptikus területen , számuk mintegy másfélezer. Jövevény sejteknek tekinthetők, ugyanis a szagló placod telepéből fejlődnek és onnan vándorolnak be az előagy mélyébe. A sejtek neuronhálózatot képeznek, mely szinkronizált működést mutat. Ennek egyik legszembetűnőbb megnyilvánulása a hormon tartalom pulzatilis ritmusban történő ürítése a hypophysis portális keringési rendszerébe . Az LHRH neuron rendszer működését a petefészek ösztrogén hormon produkciója szabályozza. Egyrészt negatív visszacsatolási mechanizmus révén gátolja, visszafogja annak működését, másrészt az ovulációt megelőzően nagy mennyiségben kiválasztott ösztrogén aktiválja az LHRH neuronokat és ezáltal az LHRH termelés és ürítés fokozódását idézi elő . Így szükségszerűnek mondható, a negatív és pozitív visszacsatolási mechanizmusok esetében egyaránt, az ösztrogén hatás közvetítése az LHRH neuron rendszer felé. Ugyanakkor, korábban végzett vizsgálatok ösztrogén receptor előfordulását LHRH neuronokban nem tudták igazolni.
Így a kutatás súlypontja a közvetett, interneuronok által közvetített ösztrogén hatás tanulmányozása irányába tevődött át az elmúlt két évtizedben. Az LHRH neuronokat beidegző neuronrendszerek közül) számos alfa típusú ösztrogén receptort tartalmaz. A közvetett reguláció tanában, az LHRH neuronok afferens rendszereinek működését változtatja meg az ösztrogén genomiális mechanizmus révén, mely következményeként megváltozik a sejtek szinaptikus kommunikációja. Az afferens neuron csoportok így a hormonális szignált receptoraikon keresztül felvevő és annak hatását szinaptikus úton közvetítő modulátor rendszernek tekinthetők. Saját vizsgálatainkból merítve példát, Fekete és munkatársai az agy hisztamint termelő neuron csoportjaiban (E1-E5) ERa immunreaktivitást mutattak ki a sejtek mintegy 80 %-ban. Az LHRH neuronok felszínére vetülő hisztaminerg idegsejtek axonjait azonosították rágcsáló és humán agyban egyaránt, valamint bizonyították, hogy az axo-szomatikus és axo-dendritikus kommunikáció révén felszabaduló transzmitter H1 típusú receptorokon keresztül befolyásolja az LHRH neuronok élettevékenységét.
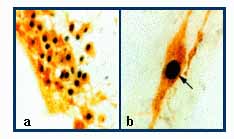
7. ábra. ERa-immunreaktivitást mutató hisztaminerg sejtek. a. E2 hisztaminerg almag. b. Kettősen jelölt sejt nagy nagyítású képe, a nyíl az ERa-immunreaktív sejtmagot jelzi a hisztaminerg neuronban. Fekete Csaba anyagából.
Az ERb felfedezése ismét megnyitotta azt a kutatási irányvonalat, mely az ösztrogén direkt, genomiális hatásának vizsgálatát tűzte ki célul LHRH neuronokban.
Közvetlen, genomiális ösztrogén hatás LHRH neuronokban
A hagyományos izotópos in situ hibridizációs hisztokémiai módszer érzékenyítése lehetőséget teremtett alacsony mRNS expressziós szintek szöveti kimutatására. Kettős in situ hibridizációs eljárás alkalmazásával, elsőként Hrabovszky és munkatársainak sikerült igazolnia ERb mRNS expresszió tényét hím és nőstény patkányok LHRH neuronjaiban . A receptor funkcionális voltát radioaktív-ösztradiol kötés igazolásával is bizonyították LHRH idegsejtekben. Továbbá, karakterizált ERb ellenes immunsavó felhasználásával, magát az ERb fehérjét is azonosította munkacsoportunk az LHRH neuronok túlnyomó többségében (8. ábra).
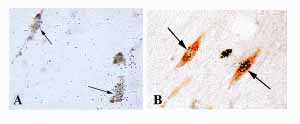
8. ábra. ERb mRNS (A)
és ERb fehérje (B) expresszió LHRH neuronokban
(nyilak).
Hrabovszky Erik anyagából
Az ERb expressziót immortalizált LHRH neuronok tenyészetében is sikerült igazolni . Vizsgálataink ugyanakkor ERa mRNS expresszióját nem tudták kimutatni LHRH neuronokban. Nevezett eredményeink az ERb szerepét igazolják a direkt, LHRH sejteken kifejtett genomiális ösztrogén hatás közvetítésében. Vizsgálataink, egy húsz esztendeje uralkodó nézettel szemben felállított munkahipotézist bizonyítottak, utat nyitva az ösztrogén-ERb complex szerepének vizsgálatához az LHRH neuronok transzkripciós folyamatainak szabályozásában. Eredményeink egy neuroendokrin szabályozó mechanizmus „végső elemét” (ERb azonosították és tették zárttá - a direkt visszacsatolás igazolása révén - a hypothalamus-hypophysis-petefészek tengely szabályozó körét.
Az ösztrogén hormonok LHRH sejtműködésre kifejtett „több-csatornás szabályozó mechanizmus” elvét a 9. ábrában foglaljuk össze. A hormon hatás 1./ közvetlen, genomiális mechanizmus révén ERb receptoron, 2./ ösztrogén receptív (ERa, ERb) interneuronok segítségével, közvetett módon szinaptikus kapcsolatok révén, valamint 3./ a sejtek membránján keresztül érvényesül.
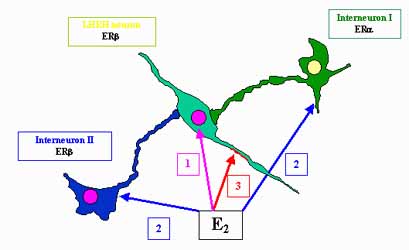
9. ábra. Az LHRH neuronra ható ösztrogén hatások csatornái. 1= direkt genomiális hatás; 2=indirekt hatás interneuronok közvetítésével; 3= membrán hatás
Jövőbeli vizsgálatok, perspektívák
Az elmúlt évek sikeres gyógyszeripari kutatásai eredményeként ERb specifikus ligandumokat sikerült előállítani, melyek az alapkutatás számára már elérhetőek.
Folyó vizsgálatainkkal az ERb analógoknak a hypothalamus neuroszekretoros rendszereire és az agykéreg idegi hálózataira kifejtett hatását tanulmányozzuk. Kivételes in vitro vizsgálati lehetőséget nyújt számunkra - a korábban általunk is karakterizált - immortalizált LHRH neuronok (GT1-7 sejtek) használata. A neuronok ösztrogén receptorokat expresszálnak (10. ábra), így alkalmasak a szteroid hatás feldolgozásában résztvevő mechanizmusok vizsgálatára. Előzetes DNS chip módszerrel végzett kollaboratív (Merchenthaler István, Wyeth-Ayerst Research, USA) vizsgálati eredményeink azt mutatják, hogy mintegy 60 gén expresszióját szabályozza ösztrogén a GT sejtekben. A szabályozó mechanizmusok feltárása laboratóriumunk egyik fő jövőbeli célkitűzése.
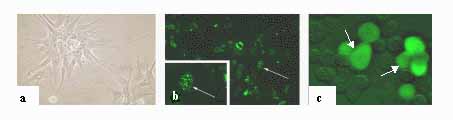
10. ábra. Immortalizált GT idegsejtek használata in vitro hatásmechanizmus
vizsgálatokra. a. Neuronális fenotípust mutató, nyúlványos GT sejtek
fázis-kontraszt mikroszkópos képe. b. ERb-immunreaktivitás
GT neuronokban (nyilak). c. Zöld fluoreszcens protein (GFP)-t kódoló
expressziós vektorral transzfektált GT sejtek
A béta típusú ösztrogén receptoron keresztül ható farmakonok előállítása a csontrendszer, véredény és az agyszövet időskori, részben a csökkenő ösztrogén hormonszintek következtében kialakuló károsodások megelőzésére jelenthet új terápiás lehetőséget. A posztmenopausális hormonpótlás (HRT) gyakorlata terén az ideg-, csont- és érszövet védelme remélhető ERb-specifikus farmakonok jövőbeli alkalmazásától. Alapkutatás szintű vizsgálatainkkal szeretnénk hozzájárulni a receptor hatásmechanizmusainak feltárásához és eredményeinkkel támogatni a béta-típusú receptoron keresztül ható gyógyszerek fejlesztését.
Köszönetemet fejezem ki Dr. Kalló Imre, Dr. Hrabovszky Erik, Dr.
Fekete Csaba, Dr. Hajszán Tibor, Dr. Gereben Balázs és Varju Patrícia
munkatársaimnak, valamint Dr. Merchenthaler István, Dr. Nyáry István
és Dr. Slowik Felícia együttműködő partnereimnek értékes munkájukért.
A vizsgálatokat az OTKA, ETT, EU FW 5 támogatta.
IRODALOM
1. Evans, R.M.: The steroid and thyroid hormone receptor superfamily.
Science. (1988). 240. 889-895. p
2. Kuiper, G.G., Enmark, E., Pelto-Huikko, M., Nilsson, S. és Gustafsson,
J.A.: Cloning of a novel receptor expressed in rat prostate and ovary.
Proc Natl Acad Sci U S A. (1996). 93. 5925-5930. p
3. Hrabovszky, E., Kallo, I., Hajszan, T., Shughrue, P.J., Merchenthaler,
I. és Liposits, Z.: Expression of estrogen receptor-beta messenger ribonucleic
acid in oxytocin and vasopressin neurons of the rat supraoptic and paraventricular
nuclei. Endocrinology. (1998). 139. 2600-2604. p
4. Coen, C., Kalló, I., Butler, J. és Barkovics-Kalló, M.: Differential
presence of immunoreactivity for estrogen receptor beta in calcium-binding
protein-containing cortical neurons of the rat. Soc. Neurosci. Abstract.
(2001). 13209. p
5. Hrabovszky, E., Shughrue, P.J., Merchenthaler, I., Hajszán, T.,
Carpenter, C.D., Liposits, Z. és Petersen, S.L.: Detection of estrogen
receptor-beta messenger ribonucleic acid and 125I-estrogen binding sites
in luteinizing hormone-releasing hormone neurons of the rat brain. Endocrinology.
(2000). 141. 3506-3509. p
6. Hrabovszky, E., Steinhauser, A., Barabás, K., Shughrue, P.J., Petersen,
S.L., Merchenthaler, I. és Liposits, Z.: Estrogen receptor-beta immunoreactivity
in luteinizing hormone-releasing hormone neurons of the rat brain. Endocrinology.
(2001). 142. 3261-3264. p
7. Kalló, I., Butler, J.A., Barkovics-Kalló, M., Goubillon, M.L. és
Coen, C.W.: Oestrogen receptor beta-immunoreactivity in gonadotropin releasing
hormone-expressing neurones: regulation by oestrogen. J Neuroendocrinol.
(2001). 13. 741-748. p
8. Baulieu, E.E., Robel, P. és Schumacher, M.: Neurosteroids: beginning
of the story. Int Rev Neurobiol. (2001). 46. 1-32. p
9. Mellon, S.H. és Griffin, L.D.: Neurosteroids: biochemistry and clinical
significance. Trends Endocrinol Metab. (2002). 13. 35-43. p
10. Woolley, C.S.: Effects of estrogen in the CNS. Curr Opin Neurobiol.
(1999). 9. 349-354. p
11. Yankova, M., Hart, S.A. és Woolley, C.S.: Estrogen increases synaptic
connectivity between single presynaptic inputs and multiple postsynaptic
CA1 pyramidal cells: a serial electron-microscopic study. Proc Natl Acad
Sci U S A. (2001). 98. 3525-3530. p
12. Aranda, A. és Pascual, A.: Nuclear hormone receptors and gene expression.
Physiol Rev. (2001). 81. 1269-1304. p
13. Pratt, W.B. és Toft, D.O.: Steroid receptor interactions with heat
shock protein and immunophilin chaperones. Endocr Rev. (1997). 18. 306-360.
p
14. McKenna, N.J., Lanz, R.B. és O'Malley, B.W.: Nuclear receptor coregulators:
cellular and molecular biology. Endocr Rev. (1999). 20. 321-344. p
15. Levin, E.R.: Cell localization, physiology, and nongenomic actions
of estrogen receptors. J Appl Physiol. (2001). 91. 1860-1867. p
16. Falkenstein, E., Tillmann, H.C., Christ, M., Feuring, M. és Wehling,
M.: Multiple actions of steroid hormones--a focus on rapid, nongenomic
effects. Pharmacol Rev. (2000). 52. 513-556. p
17. McEwen, B.S. és Alves, S.E.: Estrogen actions in the central nervous
system. Endocr Rev. (1999). 20. 279-307. p
18. McDonnell, D.P.: The Molecular Pharmacology of SERMs. Trends Endocrinol
Metab. (1999). 10. 301-311. p
19. Felerkó, B. és Szentágothai, J.: Oestrogen sensitive nervous structures
in the hypothalamus. Acta Endocrinol. (1957). 26. 121-126. p
20. Stumpf, W.E.: Estradiol-concentrating neurons: topography in the
hypothalamus by dry-mount autoradiography. Science. (1968). 162. 1001-1003.
p
21. Pfaff, D.W.: Autoradiographic localization of radioactivity in
rat brain after injection of tritiated sex hormones. Science. (1968). 161.
1355-1356. p
22. Jensen, E.V.: Intracellular localization of estrogen receptors:
implications for interaction mechanism. Lab Invest. (1984). 51. 487-488.
p
23. Liposits, Z., Kalló, I., Coen, C.W., Paull, W.K. és Flerkó, B.:
Ultrastructural analysis of estrogen receptor immunoreactive neurons in
the medial preoptic area of the female rat brain. Histochemistry. (1990).
93. 233-239. p
24. Kalló, I., Fekete, C., Coen, C.W. és Liposits, Z.: Synaptic connections
between substance P-containing axons and estrogen receptor-synthesizing
neurons in the medial preoptic area of the rat brain. Brain Res. (1998).
781. 335-338. p
25. Kalló, I., Liposits, Z., Flerkó, B. és Coen, C.W.: Immunocytochemical
characterization of afferents to estrogen receptor-containing neurons in
the medial preoptic area of the rat. Neuroscience. (1992). 50. 299-308.
p
26. Green, S., Walter, P., Kumar, V., Krust, A., Bornert, J.M., Argos,
P. és Chambon, P.: Human oestrogen receptor cDNA: sequence, expression
and homology to v-erb-A. Nature. (1986). 320. 134-139. p
27. Greene, G.L., Gilna, P., Waterfield, M., Baker, A., Hort, Y. és
Shine, J.: Sequence and expression of human estrogen receptor complementary
DNA. Science. (1986). 231. 1150-1154. p
28. Greene, G.L. és Press, M.F.: Structure and dynamics of the estrogen
receptor. J Steroid Biochem. (1986). 24. 1-7. p
29. Simerly, R., Chang, C. és Muramatsu, M.: Distribution of androgen
and estrogen receptor mRNA-containing cells in the rat brain: an in situ
hybridization study. J. Comp. Neurol. (1990). 294. 76-95. p
30. Lubahn, D.B., Moyer, J.S., Golding, T.S., Couse, J.F., Korach,
K.S. és Smithies, O.: Alteration of reproductive function but not prenatal
sexual development after insertional disruption of the mouse estrogen receptor
gene. Proc Natl Acad Sci U S A. (1993). 90. 11162-11166. p
31. Couse, J.F. és Korach, K.S.: Reproductive phenotypes in the estrogen
receptor-alpha knockout mouse. Ann Endocrinol (Paris). (1999). 60. 143-148.
p
32. Shughrue, P.J., Lubahn, D.B., Negro-Vilar, A., Korach, K.S. és
Merchenthaler, I.: Responses in the brain of estrogen receptor alpha-disrupted
mice. Proc Natl Acad Sci U S A. (1997). 94. 11008-11012. p
33. Herbison, A.E. és Pape, J.R.: New evidence for estrogen receptors
in gonadotropin-releasing hormone neurons. Front Neuroendocrinol. (2001).
22. 292-308. p
34. Kuiper, G.G., Shughrue, P.J., Merchenthaler, I. és Gustafsson,
J.A.: The estrogen receptor beta subtype: a novel mediator of estrogen
action in neuroendocrine systems. Front Neuroendocrinol. (1998). 19. 253-286.
p
35. Kuiper, G.G., Lemmen, J.G., Carlsson, B., Corton, J.C., Safe, S.H.,
van der Saag, P.T., van der Burg, B. és Gustafsson, J.A.: Interaction of
estrogenic chemicals and phytoestrogens with estrogen receptor beta. Endocrinology.
(1998). 139. 4252-4263. p
36. Nilsson, S., Makela, S., Treuter, E., Tujague, M., Thomsen, J.,
Andersson, G., Enmark, E., Pettersson, K., Warner, M. és Gustafsson, J.A.:
Mechanisms of estrogen action. Physiol Rev. (2001). 81. 1535-1565. p
37. Krege, J.H., Hodgin, J.B., Couse, J.F., Enmark, E., Warner, M.,
Mahler, J.F., Sar, M., Korach, K.S., Gustafsson, J.A. és Smithies, O.:
Generation and reproductive phenotypes of mice lacking estrogen receptor
beta. Proc Natl Acad Sci U S A. (1998). 95. 15677-15682. p
38. Couse, J.F. és Korach, K.S.: Estrogen receptor null mice: what
have we learned and where will they lead us? Endocr Rev. (1999). 20. 358-417.
p
39. Couse, J.F., Hewitt, S.C., Bunch, D.O., Sar, M., Walker, V.R.,
Davis, B.J. és Korach, K.S.: Postnatal sex reversal of the ovaries in mice
lacking estrogen receptors alpha and beta. Science. (1999). 286. 2328-2331.
p
40. Couse, J.F., Lindzey, J., Grandien, K., Gustafsson, J.A. és Korach,
K.S.: Tissue distribution and quantitative analysis of estrogen receptor-alpha
(ERalpha) and estrogen receptor-beta (ERbeta) messenger ribonucleic acid
in the wild-type and ERalpha-knockout mouse. Endocrinology. (1997). 138.
4613-4621. p
41. Merchenthaler, I. és Shugrue, P.J.: Estrogen receptor-beta: a novel
mediator of estrogen action in brain and reproductive tissues. Morphological
considerations. J Endocrinol Invest. (1999). 22. 10-12. p
42. Osterlund, M., Kuiper, G.G., Gustafsson, J.A. és Hurd, Y.L.: Differential
distribution and regulation of estrogen receptor-alpha and -beta mRNA within
the female rat brain. Brain Res Mol Brain Res. (1998). 54. 175-180. p
43. Saji, S., Jensen, E.V., Nilsson, S., Rylander, T., Warner, M. és
Gustafsson, J.A.: Estrogen receptors alpha and beta in the rodent mammary
gland. Proc Natl Acad Sci U S A. (2000). 97. 337-342. p
44. Shughrue, P.J., Lane, M.V. és Merchenthaler, I.: Comparative distribution
of estrogen receptor-alpha and -beta mRNA in the rat central nervous system.
J Comp Neurol. (1997). 388. 507-525. p
45. Shughrue, P.J., Lane, M.V., Scrimo, P.J. és Merchenthaler, I.:
Comparative distribution of estrogen receptor-alpha (ER-alpha) and beta
(ER-beta) mRNA in the rat pituitary, gonad, and reproductive tract. Steroids.
(1998). 63. 498-504. p
46. Shughrue, P.J. és Merchenthaler, I.: Distribution of estrogen receptor
beta immunoreactivity in the rat central nervous system. J Comp Neurol.
(2001). 436. 64-81. p
47. Weihua, Z., Saji, S., Makinen, S., Cheng, G., Jensen, E.V., Warner,
M. és Gustafsson, J.A.: Estrogen receptor (ER) beta, a modulator of ERalpha
in the uterus. Proc Natl Acad Sci U S A. (2000). 97. 5936-5941. p
48. Weihua, Z., Makela, S., Andersson, L.C., Salmi, S., Saji, S., Webster,
J.I., Jensen, E.V., Nilsson, S., Warner, M. és Gustafsson, J.A.: A role
for estrogen receptor beta in the regulation of growth of the ventral prostate.
Proc Natl Acad Sci U S A. (2001). 98. 6330-6335. p
49. Shughrue, P., Scrimo, P., Lane, M., Askew, R. és Merchenthaler,
I.: The distribution of estrogen receptor-beta mRNA in forebrain regions
of the estrogen receptor-alpha knockout mouse. Endocrinology. (1997). 138.
5649-5652. p
50. Shughrue, P.J. és Merchenthaler, I.: Evidence for novel estrogen
binding sites in the rat hippocampus. Neuroscience. (2000). 99. 605-612.
p
51. Carroll, R.S., Zhang, J. és Black, P.M.: Expression of estrogen
receptors alpha and beta in human meningiomas. J Neurooncol. (1999). 42.
109-116. p
52. Campbell-Thompson, M., Lynch, I.J. és Bhardwaj, B.: Expression
of estrogen receptor (ER) subtypes and ERbeta isoforms in colon cancer.
Cancer Res. (2001). 61. 632-640. p
53. Royuela, M., de Miguel, M.P., Bethencourt, F.R., Sanchez-Chapado,
M., Fraile, B., Arenas, M.I. és Paniagua, R.: Estrogen receptors alpha
and beta in the normal, hyperplastic and carcinomatous human prostate.
J Endocrinol. (2001). 168. 447-454. p
54. Lazennec, G., Bresson, D., Lucas, A., Chauveau, C. és Vignon, F.:
ER beta inhibits proliferation and invasion of breast cancer cells. Endocrinology.
(2001). 142. 4120-4130. p
55. Witte, D., Chirala, M., Younes, A., Li, Y. és Younes, M.: Estrogen
receptor beta is expressed in human colorectal adenocarcinoma. Hum Pathol.
(2001). 32. 940-944. p
56. Takano, N., Iizuka, N., Hazama, S., Yoshino, S., Tangoku, A. és
Oka, M.: Expression of estrogen receptor-alpha and -beta mRNAs in human
gastric cancer. Cancer Lett. (2002). 176. 129-135. p
57. Saunders, P.T., Millar, M.R., Williams, K., Macpherson, S., Bayne,
C., O'Sullivan, C., Anderson, T.J., Groome, N.P. és Miller, W.R.: Expression
of oestrogen receptor beta (ERbeta1) protein in human breast cancer biopsies.
Br J Cancer. (2002). 86. 250-256. p
58. Shughrue, P.J., Komm, B. és Merchenthaler, I.: The distribution
of estrogen receptor-beta mRNA in the rat hypothalamus. Steroids. (1996).
61. 678-681. p
59. Orikasa, C., Kondo, Y., Hayashi, S., McEwen, B.S. és Sakuma, Y.:
Sexually dimorphic expression of estrogen receptor beta in the anteroventral
periventricular nucleus of the rat preoptic area: implication in luteinizing
hormone surge. Proc Natl Acad Sci U S A. (2002). 99. 3306-3311. p
60. Patisaul, H.B., Whitten, P.L. és Young, L.J.: Regulation of estrogen
receptor beta mRNA in the brain: opposite effects of 17beta-estradiol and
the phytoestrogen, coumestrol. Brain Res Mol Brain Res. (1999). 67. 165-171.
p
61. Schally, A.V., Nair, R.M., Redding, T.W. és Arimura, A.: Isolation
of the luteinizing hormone and follicle-stimulating hormone-releasing hormone
from porcine hypothalami. J Biol Chem. (1971). 246. 7230-7236. p
62. Liposits, Z., Sétáló, G. és Flerkó, B.: Application of the silver-gold
intensified 3,3'-diaminobenzidine chromogen to the light and electron microscopic
detection of the luteinizing hormone-releasing hormone system of the rat
brain. Neuroscience. (1984). 13. 513-525. p
63. Knobil, E.: The hypothalamic gonadotrophic hormone releasing hormone
(GnRH) pulse generator in the rhesus monkey and its neuroendocrine control.
Hum Reprod. (1988). 3. 29-31. p
64. Knobil, E.: The electrophysiology of the GnRH pulse generator in
the rhesus monkey. J Steroid Biochem. (1989). 33. 669-671. p
65. Knobil, E.: The neuroendocrine control of ovulation. Hum Reprod.
(1988). 3. 469-472. p
66. Shivers, B.D., Harlan, R.E., Morrell, J.I. és Pfaff, D.W.: Absence
of oestradiol concentration in cell nuclei of LHRH-immunoreactive neurones.
Nature. (1983). 304. 345-347. p
67. Kiss, J. és Halász, B.: Demonstration of serotoninergic axons terminating
on luteinizing hormone-releasing hormone neurons in the preoptic area of
the rat using a combination of immunocytochemistry and high resolution
autoradiography. Neuroscience. (1985). 14. 69-78. p
68. Leranth, C., MacLusky, N.J., Sakamoto, H., Shanabrough, M. és Naftolin,
F.: Glutamic acid decarboxylase-containing axons synapse on LHRH neurons
in the rat medial preoptic area. Neuroendocrinology. (1985). 40. 536-539.
p
69. Tsuruo, Y., Kawano, H., Kagotani, Y., Hisano, S., Daikoku, S.,
Chihara, K., Zhang, T. és Yanaihara, N.: Morphological evidence for neuronal
regulation of luteinizing hormone-releasing hormone-containing neurons
by neuropeptide Y in the rat septo-preoptic area. Neurosci Lett. (1990).
110. 261-266. p
70. Fekete, C.S., Strutton, P.H., Cagampang, F.R., Hrabovszky, E.,
Kallo, I., Shughrue, P.J., Dobo, E., Mihaly, E., Baranyi, L., Okada, H.,
Panula, P., Merchenthaler, I., Coen, C.W. és Liposits, Z.S.: Estrogen receptor
immunoreactivity is present in the majority of central histaminergic neurons:
evidence for a new neuroendocrine pathway associated with luteinizing hormone-releasing
hormone-synthesizing neurons in rats and humans. Endocrinology. (1999).
140. 4335-4341. p
71. Liposits, Z., Merchenthaler, I., Wetsel, W.C., Reid, J.J., Mellon,
P.L., Weiner, R.I. és Negro-Vilar, A.: Morphological characterization of
immortalized hypothalamic neurons synthesizing luteinizing hormone-releasing
hormone. Endocrinology. (1991). 129. 1575-1583. p
72. Wetsel, W.C., Valenca, M.M., Merchenthaler, I., Liposits, Z., Lopez,
F.J., Weiner, R.I., Mellon, P.L. és Negro-Vilar, A.: Intrinsic pulsatile
secretory activity of immortalized luteinizing hormone-releasing hormone-secreting
neurons. Proc Natl Acad Sci U S A. (1992). 89. 4149-4153. p
Steroid actions in the central nervous system: role of the novel
estrogen receptor beta in physiological and pathological regulatory mechanisms
Zsolt Liposits
Hungarian Academy of Sciences, Institute of Experimental Medicine, Department of Neurobiology
Steroid hormones are synthesized in the brain, gonads, adrenal cortex and placenta. They exert their actions via the cell membrane, secondary messenger systems and cell nucleus. The steroid molecules are sensed by specific receptors that belong to the thyroid, steroid, vitamin D3, orphan superfamily of nuclear receptors. The different structural domains of the receptor are responsible for distinct, highly specific actions. The ligand activated receptor - by the cooperation of nuclear coregulators – regulates the machinery of gene transcription. Estrogens regulate sexual differentiation, maturation of female germ cells, reproductive functions and also determine the physiological operation of the skeletal, vascular and neuronal systems. In addition to the classical estrogen receptor, Kuiper et al., (Proc. Natl. Acad. Sci US. 93:5925- 5930) have cloned a novel subtype of estrogen receptor from a prostate cDNA library. The new estrogen receptor beta (ERb) is widely distributed in several organ systems, including the nervous, reproductive, skeletal and vascular systems. Changes in the expression pattern of the receptor have also been found in different pathological cases (breast cancer, prostate cancer, meningeoma).
Studies of our group focus on the elucidation of regulatory mechanisms that utilize ERb in the mediation of estrogen effects. Our immunocytochemical studies verified the dominant occurrence of the receptor in the cell nuclei. The receptor expression depends on the level of the ligand and shows locus and tissue specificity. In the hypothalamus, the ultrastructural analysis of the receptor revealed its binding to the chromatin substance. Contrasting the nuclear residence, the receptor is also expressed in the cytoplasmic domain of principal neurons in the hippocampal formation and neocortex. The data support the view that the novel receptor participates both in genomic and non-genomic regulatory mechanisms. Studying the chemotype of target neurons, we discovered the expression of ERb in the oxytocin- and vasopressin-synthesizing hypothalamic neurons (Hrabovszky et al., Endocrinology, 139:2600-2604, 1998), and in calcium-binding protein producing interneurons of the cerebral cortex (Coen et al., Soc. for Neurosci. Abst. No: 13209, 2001). The luteinizing hormone–releasing hormone (LHRH)-synthesizing neurons that regulate the hypothalamo-hypophyseal-gonadal system were also found to express ERb mRNA and ERb protein in 80 % of the cells (Hrabovszky et al., Endocrinology, 141:3506-3509, 2000; Hrabovszky et al., Endocrinology, 142: 3261-3264, 2001; Kalló et al., J. Neuroendocrinology, 13: 741-748, 2001). Our results were the first to demonstrate that estrogens are also capable of influencing the LHRH neuronal function via genomic mechanisms utilizing estrogen receptor beta.
Our current studies use transgenic animals (ERKO, BERKO, GFP-LHRH) and
in vitro (GT neurons, organotypic slice) models for elucidating
the cellular and molecular mechanisms of the receptor action. The recently
available, ERb-specific pharmacological ligands
represent a real challenge in the future therapy of estrogen-dependent
osteoporosis, heart diseases and deteriorated cognitive functions and they
might significantly contribute to the improvement of quality of life.
(Supported by OTKA, ETT, EU FW5 and WAR)
| Gyógyszerkutatás: jelen és jövő | http://www.kfki.hu/chemonet/
http://www.chemonet.hu/ |