
Molekuláris oldatkémia
A rácsmodellektõl a molekuladinamikai konfigurációkig
Pálinkás Gábor
a Magyar Tudományos Akadémia levelezõ
tagja
A következõkben az oldószerekben és oldatokban lokálisan megjelenõ rendezetlenségre és a molekulák hosszú távú szervezõdésére mutatok példákat saját munkáinkból.
 |
| 16.ábra |
A példák molekulárisak lesznek és alapjuk minden esetben szimulációkkal elõállított molekula-konfigurációk voltak. A szimulációkról csak annyit említek, hogy a rendszerek számos fizikai-kémiai tulajdonságának reprodukciója mellett, a konfigurációkon számított szerkezeti függvények minden esetben jól megegyeztek a diffrakciós kísérletekben mért szerkezeti függvényekkel. Ez utóbbira láthatunk példát a (16.ábrán), amely a vízmolekulák kísérleti és molekuladinamikai számításokkal meghatározott három az OO, OH és HH atomi páreloszlás függvényeit hasonlítja össze.
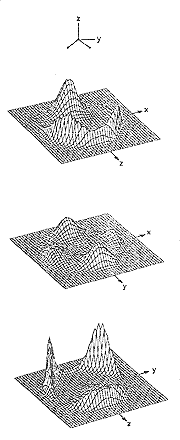
Kezdjük talán a példákat a vízmolekulák és az ionok elsõszomszéd környezete szimmetriájának kérdésével víz-ben illetve vizes elektrolitoldatokban. A korai vízmodellek többsége feltételezte, hogy vízben, a jéghez hasonlóan, a molekulák elsõszomszéd környezete tetraéderes szimmet-riájú. A molekuladinamikai konfigurációk birtokában, az összes molekula koordinátájának ismeretében egyszerûen elvégezhetõ a szimmetriavizsgálat. Illesszünk koordináta rendszert a vízmolekulákhoz az origóval a tömegközép-pontban. Legyen a z tengely iránya az antidipolús irányban, az y tengely erre merõlegesen a molekula síkjában és az x tengely merõleges a molekula síkjára. Vetítsük a koordináta rendszer síkjaira a molekulák négy szomszédjának pozícióját és átlagoljuk ezeket a vetületeket az összes molekulára. A szobahõmérsékletû víz molekuladinamikai modelljének három vetületeloszlását mutatja be a 17. ábra.
 |
| 17. ábra |
Az vetületeloszlások tükrözik a tetraéderes irányok kitüntettségét. Egy relaxált tetraéderes szerkezet ezzel azonos eloszlásokhoz vezet. A felsõ ábra a szomszédok vetület-eloszlását ábrázolja a molekula síkjában. A két csúcs a hidrogének irányába esõ szomszédok vetületeivel, a harmadik a síkra merõleges magános elektronpár irányú szomszédok egybeesõ vetületeivel azonosítható.
Az alsó ábra a magános elektronpár síkja az egybeesõ hidrogén szomszédok és felbomló magános elekronpár irányú szomszédok vetületeivel. A középsõ a két elõzõre merõleges ekvatoriális sik és ezen mind a négy szomszéd vetülete megkülönböztethetõ. Bár a tetraéderes irányok jól felismerhetõk, nem elhanyagolható a vetületeloszlások szélessége. Ez utóbbi eredményezi azt, hogy a négy irány körül kinyitott 40 fokos kúpszszögekben egyidejûleg átlagosan csak két vízmolekula tartózkodik és a négy kúpszög egyidejû populációját a vízmolekulák csak kevesebb mint 10 százaléka valósítja meg (18.ábra, jobb oldal). Megállapíthatjuk, hogy az intermolekuláris kötés szögének eloszlása miatt a rendszerben a lokális környezet térbeli tetraéderes szimmetriája erõsen torzult.
Változatos az ionok hidrátszféráinak szimmetriája vizes elektrolioldatokban. A 19. ábra az elõzõhez hasonlóan az kationok és anionok körüli hidratált vízmolekulák vetületeit ábrázolja az ioncentrumú hidrátszférákhoz rögzített koordinátarendszerek ekvatoriális síkjain. A a Li+ körül hidratált vízmolekulák átlagos vetületeloszlása oktaéderes szimmetriára jellemzõ. Az oktaéder ekvatoriális síkjában négy szomszéd van és a sík feletti és alatti két szomszéd helyzete egymásra vetítõdik. Az eloszlások szélessége az növekvõ ionsugárral rohamosan növekszik és az eloszlások elmosódnak.

18. ábra
Az anionok hidrátszférájának szimmetriája nem felismerhetõ. Markáns oktaéderes szimmetria figyelhetõ meg a a kis sugarú Mg++ ion hidrátszférájában (20. ábra). A vetületeloszlások éles csúcsokat mutatnak, a hat oktaéderes irányba kinyitott 40 fokos kúpszögekben egyidejûleg az ionok 60 százalékában találhatunk vízmolekulákat (lásd 18. ábrát). A lítium esetében az ionok 10, a többi esetben ennél jóval kevesebb százalékában található egyidejûleg 6 vízmolekula az oktaéderes irányokban. Mivel a legtöbb bemutatott ionnak hat a koordinációs száma, levonhatjuk azt a következtetést, hogy nem minden hatos koordinációs számú ionnak oktaéderes a hidrátszférája.
 |
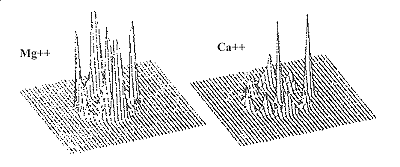 |
| 19. ábra | 20. ábra |
A kalciumionok hidrátszféráiának különös közelítõ szimmetriáit figyeltük meg a kalcium-klorid vizes oldatainak konfigurációiban (20.ábra). A kalciumionokat 9 vízmolekulával koordináló hidrátszféra olyan poliédert képez, amely szimmetriája, ha eltekintünk attól, hogy élei nem pontosan egyenlõk (+/–- 0.03 nm), a D3h pontcsoportba osztályozható. Megmutattuk, hogy ilyen poliéderek családja jön létre akkor, ha egy gömbfelületen elhelyezkedõ 9 ponttól elvárjuk, hogy a pontok közötti legkisebb távolság maximális legyen (21.ábra). A kalciumionok hidrátszférájának szimmetriatorzulása a rövidtávú rendezetlenség megvalósulásának sajátos esete.
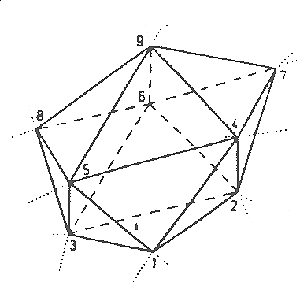 |
| 21. ábra |
A bemutatott példákkal azt szerettem volna illusztrálni, hogy folyadékállapotban a lokális rendezettség széles skálán mozoghat a molekulapárok kölcsönhatási energiájától függõen. A térbeli szimmetriát megõrzõ szerkezetektõl a csak kétrészecske korrelációt fenntartó statisztikus szerkezetekig terjedhet.
Térjünk át most a téma második részére, a szupramolekuláris szervezõdésre, a molekulahálókra. Ehhez elõször vizsgáljuk meg az intermolekuláris kötés definícióját (22.ábra). Az intermolekuláris kötés keletkezéséhez elõször szükséges, hogy a partnerek közvetlen szomszédok legyenek. A szomszédok eloszlását bármely centrális molekula körül a páreloszlás függvény jellemzi. Az ábrán felül a víz oxigénjeinek páreloszlás függvényét láthatjuk.
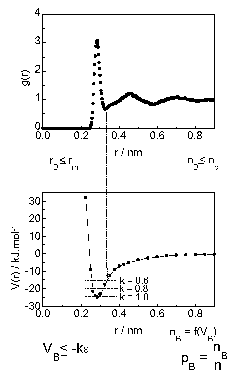 |
| 22. ábra |
Következô rész
Vissza a tartalomjegyzékhez