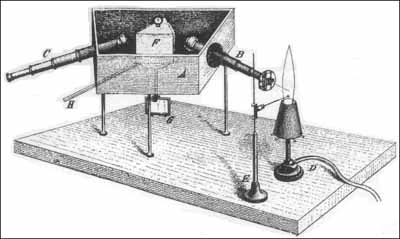
3-1. ábra
Kémiai analízis a spektrumok alapján
Részletek
Annalen der Physik und der Chemie (Poggendorff), Vol. 110 (1860), pp. 161–189
A ChemTeam gyûjteményébõl
Ismeretes, hogy egyes anyagok fényes vonalakat keltenek, ha lángba vetjük õket. Ezekre a vonalakra kvalitatív kémiai analitikai módszert alapozhatunk, miáltal a kémiai reakciók köre jelentõsen bõvül és eddig kezelhetetlennek tartott problémák is megoldhatók. Itt csak az alkáli- és alkáliföldfémekre terjesztjük ki a módszert és néhány példán mutatjuk be hatékonyságát.
A vonalak annál határozottabban jelennek meg, minél magasabb a hõmérséklet és minél kevésbé fénylik a láng. Annak a gázégõnek, amelyet egyikünk már ismertetett (Bunsen, ezen Ann. 100, p. 85), nagyon magas hõmérsékletû és kevéssé fényes a lángja, ezért rendkívül alkalmas arra, hogy a fent említett anyagokra jellemzõ fényes vonalakkal kísérleteket végezzünk.

3-1. ábra
A 3-1. ábra a spektrumok észlelésére szolgáló készüléket mutatja. A belülrõl feketére festett doboz; trapéz alakú alja három lábon nyugszik. A két ferde oldalfal körülbelül 58o-os szöget zár be egymással, ezekbe van erõsítve a B és C távcsõ. Az elõbbi okulárját egy lemez helyettesíti, amelyen két sárgaréz széllel határolt rés van. A rés az objektív lencse fókuszába esik. A D lámpa úgy áll a rés elõtt, hogy a láng széle a B csõ tengelyére essen. Nem sokkal az alatt a hely alatt, ahol a tengely eléri a lángot, végzõdik egy vékony plantinahuzalból készült hurok, melyet az E állvány tart. A vizsgálni kívánt, gyöngyszemnyi, száraz klórvegyületet erre a hurokra olvasztjuk. A B és C távcsõ objektív lencséi között van a szén-diszulfiddal töltött F prizma, amelynek törési szöge 60o. A prizma olyan sárgaréz lapon nyugszik, amely függõleges tengelye körül elforgatható. Ennek a tengelynek az alján egy G tükör van. A tükör és a prizma a H karral forgatható. A tükörre egy kis távcsõ irányul, hogy az észlelõ láthassa a közelében elhelyezett, vízszintes skálát. A prizma forgatása nyomán a láng teljes spektruma elvonulhat a C távcsõ fonalkeresztje elõtt. ... A spektrum minden része megfelel egy leolvasott skálaértéknek. Ha a spektrum nagyon gyenge, a C fonalkeresztjét egy lencsével világítjuk meg, amely egy lámpa sugarainak egy részét egy kis nyíláson át a C okulárcsövének oldalára irányítja
A fent említett klórvegyületek spektrumát összevetettük a fémek bromidjainak, jodidjainak, oxidjainak, szulfátjainak és karbonátjainak spektrumaival, amelyeket kén, szén-dioxid, vizes alkohol, világítógáz, szén-monoxid, hidrogén és durranógáz lángjával vettünk fel.
A most ismertetendõ, hosszadalmas, kiterjedt vizsgálatok során kiderült, hogy a sokféle vegyület, amelyben a fémeket vizsgáltuk, valamint a lángok eltérõ kémiai folyamatai és a lángok hõmérséklete közötti nagy eltérések nem befolyásolják az egyes fémeknek megfelelõ spektrumvonalak helyét.
Nátrium
Az összes spektrális reakció közül a nátriumé
a legérzékenyebb. Swann (ezen Ann. 100, p. 311) már
felhívta a figyelmet arra, hogy milyen kis mennyiségû
nátrium-klorid képes jól érzékelhetõ
nátriumvonalat adni.
A következõ kísérlet azt mutatja, hogy nincs olyan kémiai reakció, amelynek érzékenysége vetekedhetne a nátrium eme spektrális analitikai meghatározásával. 60 m3-es szobánk egyik sarkában, a berendezéstõl legtávolabb, tejcukorral együtt felrobbantottunk 3 mg nátrium-klorátot, miközben a rés elõtti fénytelen lángot figyeltük. Néhány perc múlva a láng fokozatosan megsárgult, és erõs nátriumvonalat mutatott, amely csak 10 perc múltán tûnt el. A nátriumsó súlyából és a szobában levõ levegõ mennyiségébõl könnyen kiszámíthatjuk, hogy egy súlyrész levegõ nem tartalmazhatott többet 1/20 milliomod súlyrész nátriumnál. A reakció kényelmesen megfigyelhetõ egy másodperc alatt, s ekkor a láng elõtt csak körülbelül 50 cm3 vagy 0,0647 g levegõ halad el, amelyben a koncentráció kisebb, mint 1/20 milliomod g/g, ami azt jelenti, hogy a szem 1/3 milliomod mg-nál kevesebb nátriumsót is jól meg tud különböztetni. A reakció ekkora érzékenysége esetén érthetõvé válik, hogy az izzás hõmérsékletén csak ritkán van olyan nátriumreakció, amely nem látszik a levegõben.
A levegõ nátrium-klorid-tartalma, amely könnyen megállapítható spektrális analízissel, más tekintetben is figyelmet érdemel. Ha – ami most már aligha vonható kétségbe – léteznek olyan katalitikus hatások, amelyek elõsegítik a betegségek miazmás terjedését, akkor a nátrium-kloridhoz hasonló fertõtlenítõ anyagok még kis mennyiségben is minden bizonnyal fontos hatást fejtenek ki a levegõben. Naponként ismétlõdõ és hosszan folytatott spektrális észlelésekkel könnyen kideríthetõ, hogy a levegõ nátrium-vegyületeitõl származó spektrumvonalak intenzitásának változásai kapcsolatban vannak-e a helyi betegségekkel vagy a betegségek terjedési irányával.
Lítium
A lítiumvegyületek izzó gõze két éles
vonalat kelt: egy sárga, gyenge Lib-t
és egy erõs, vörös Lia-t.
Ez a reakció is minden más ismert analitikai kémiai
reakciót felülmúl határozottság és
érzékenység tekintetében.
A módszer alkalmazása nyomán azt a váratlan kijelentést tehetjük minden kétséget kizáróan, hogy a természetben a lítium egyike a legelterjedtebb elemeknek.
Aligha szükséges megjegyezni, hogy ha a lítiumvonalakat a nátrium- és lítiumsók keveréke hívja életre a nátriumreakció mellett, szinte ugyanolyan élesek és jól megkülönböztethetõk, mint önmagukban. Ha 1/1000 lítiumsót tartalmazó gyöngyöt viszünk a lánga, megjelenik a lítium vörös vonala, noha puszta szemmel csak a nátrium sárga fényét látjuk mindenféle vöröses elszínezõdés nélkül. A nátriumreakció valamivel tovább tart, mert a lítiumsók illékonyabbak.
A lítiumvegyületek ipari elõállításakor a spektrális elemzés felbecsülhetetlen értékû eszköz lehet az anyagok és az eljárások kiválasztásában.
Kálium
Az illékony káliumvegyületek a lángban nagyon
hosszú, folytonos spektrumot adnak, amelynek csak két jellemzõ
vonala van: az elsõ, a Ka legtávolabbi
vörös határon van, és pontosan egybeesik
a napspektrum sötét A vonalával; a másik, a Kb
a távoli ibolyában van, és ugyancsak egybeesik egy
Fraunhofer-vonallal. Ha nagyon erõs lángot használunk,
megjelenik egy igen gyenge vonal, amely egybeesik a B Fraunhofer-vonallal,
de nem jellegzetes.
Stroncium
Az alkáliföldek spektrumai sokkal egyszerûbbek, mint
az alkálifémek spektrumai. A stronciumot különösen
a zöld vonalak hiánya jellemzi; nyolc vonal igen jelentõs,
hat vörös, egy narancs és egy kék.
Kalcium
A kalcium spektruma egyetlen pillantás alatt megkülönböztethetõ
az elõbb leírt négytõl, mert van egy nagyon
jellegzetes, erõs, zöld vonala, a Cab.
Egy másik, nem kevésbé jellegzetes, erõs narancsszínû
vonal, a Caa, sokkal messzebb van a vörös
felé, mint a nátrium vonala vagy a stroncium narancsszínû
vonala.
Bárium
Az alkáli- és alkáliföldfémek közül
a bárium spektruma a legbonyolultabb. A fent leírtaktól
különbözõ és könnyen felismerhetõ
zöld vonal a Baa és a Bab;
ezek az összes többinél erõsebbek, az elsõ
megjelenik, a másik elhalványul a gyenge reakcióban.
A Bag kevésbé érzékeny,
de jellegzetes. A spektrum arányosan nagyobb terjedelme miatt a
báriumvegyületek spektrális reakciói kissé
kevésbé érzékenyek a többinél.
Szobánkban 0,3 g bárium-klorátot égettünk
el tejcukorral, miután a levegõt alaposan összekevertük
egy nyitott esernyõvel; a Baa vonal jól
látszott egy ideig. A nátriumnál végzett számításhoz
hasonló számítással arra az eredményre
jutunk, hogy 1/1000 mg-nál kisebb mennyiség mutatható
ki a reakcióval.
A spektrumanalízisnek fontos szerepet kell játszania az eddig ismeretlen elemek felfedezésében. Ha lennének olyan anyagok, amelyekbõl oly kevés jelenik meg a természetben, hogy jelenlegi analitkai eszközeink képtelenek felismerésükre és szétválasztásukra, akkor remélhetjük, hogy sok olyan anyagot ismerhetünk meg és határozhatunk meg lángspektrumaik egyszerû vizsgálatával, melyek mennyiségét szokásos eszközeinkkel nem tudjuk kezelni. Már meg is gyõzõdhettünk arról, hogy vannak ilyen ismeretlen elemek. Spektrális analitikai módszerünk egyértelmû eredményei alapján úgy gondoljuk, kijelenthetjük, hogy az alkálicsoportban van egy negyedik fém a káliumon, a nátriumon és a lítiumon kívül; egyszerû, jellegzetes spektruma van, mint a lítiumnak; ez a fém csak két vonalat mutat a berendezésünkben: egy halványkéket, amely majdnem egybeesik a stronciuméval és egy másik kéket, amely egy kicsit távolabb van, a spektrum lila vége felé, és olyan jól megkülönböztethetõ, mint a lítium vonala.
A spektrumanalízis, amely, mint remélhetõen megmutattuk, csodálatosan egyszerû módszert kínál a földi anyagokban található egyes elemek legkisebb nyomainak a felfedezésére, a kémiai kutatás számára eleddig teljes elzárt területet is megnyit, amely jóval meghaladja a föld, sõt a naprendszer határait. Mivel ennél az analitikai módszernél elegendõ, ha az elemzendõ, izzó gázt látjuk, a módszer könnyen alkalmazható a nap és a fényes csillagok atmoszférájának vizsgálatára. A csillagokból kibocsátott fény miatt azonban módosításra van szükség. Egyikünk a testek hõ- és fényelnyelése és -kibocsátása közötti kapcsolatot vizsgálva (Kirchhoff, ezen Ann. 109, p. 275) elméletileg bebizonyította, hogy az izzó gáz spektruma megfordítható, vagyis a fényes vonalak fekete vonalakká alakulnak át, ha a gáz mögött elegendõ intenzitású, folytonos spektrumú fényforrás van. Ebbõl arra a következésre juthatunk, hogy a nap sötét vonalakat mutató spektruma éppen a fordítottja annak a spektrumnak, amelyet a nap légköre idézne elõ. Ezért a nap atmoszférájának kémiai analízisekor mindössze olyan anyagokat kell keresni, amelyek a napspektrum sötét vonalaival egybeesõ fényes vonalakat keltenek.
Annak a gázlángnak a spektruma például, amelybe egy kevés lítium-kloridot tettünk, feket vonallá változik, ha teljes napfényt engedünk át a lángon.
| Vissza | http://www.kfki.hu/chemonet/
http://www.ch.bme.hu/chemonet/ |