A különbözõ anyagok között megfigyelt eltérõ affinitásokról
Elhangzott a Tudományos Akadémián Párizsban,
1718. augusztus 27-én
Mémories de l'Académie royale des sciences, 1718:
202–212
(in: Henry Marshall Leicester and Herbert S. Klickstein, A Source Book in Chemistry 1400-1900 (Harvard University Press, Cambridge, Massachusetts, 1963)
A kémiában bizonyos affinitásokat figyelhetünk meg a különbözõ anyagok között annak alapján, hogy milyen könnyen egyesülnek egymással. Ezeknek az affinitásoknak megvan a mértéke és megvan a törvénye. A különbözõ mértékû affinitásokat akkor észleljük, amikor sok olyan anyag keverékében, amely hajlandóságot mutat az egyesülésre, azt látjuk, hogy az egyik anyag egy másikkal szívesebben egyesül, mint az összes többivel.
Az affinitások törvényét illetõen megfigyeltem, hogy amikor két, egyesülésre hajlamos anyag egymással vegyül, és egy harmadikat adunk hozzájuk, ez a harmadik elválaszthatja a másik kettõt, és magához ragadhatja az egyiket vagy a másikat. Más anyagok sem az egyikkel, sem a másikkal nem társulnak, és egyáltalán nem vesznek el belõlük. Mindezek után véleményem szerint nem alaptalan az a következtetésünk, hogy azoknak az anyagoknak, amelyek a kettõ egyikével társultak, nagyobb az affinitásuk a velük való egyesülésre, mint azoknak az anyagoknak, amelyeket helyettesítettek. Azt hiszem, ezek a megfigyelések kellõ alapot szolgáltatnak az alábbi feltevéshez, amely igen általános, bár nem tekinthetjük teljesen általánosnak, amíg meg nem vizsgáltuk az összes lehetséges vegyületet, és meg nem gyõzõdtünk arról, hogy semmi nem mond ellent.
Amikor két olyan anyag, amely hajlandóságot mutat arra, hogy egyesüljön egymással, egyesül, és egy harmadikat adunk hozzájuk, amelynek a kettõ közül az egyikhez nagyobb az affinitása, akkor a harmadik egyesül az egyikkel és ezt elválasztja a másiktól.
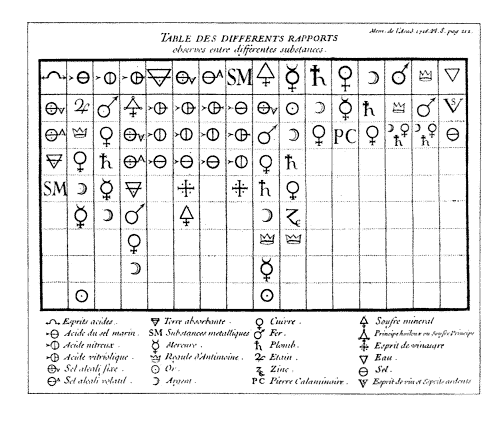
Ez a feltevés igen általános a kémiában, ahol úgyszólván lépten-nyomon ennek az affinitásnak a hatásaival találkozunk. Ettõl a tulajdonságtól függ azoknak a rejtett mozgásoknak a nagyobb része, amelyek az anyagok keveredését követik, és amelyek csaknem érthetetlenek e nélkül a kulcs nélkül. De mivel az affinitások sorrendje kevéssé ismert, úgy gondoltam, igen hasznos lenne, ha megjelölnénk azokat az affinitásokat, amelyekkel az anyagok a kémiában rendszerint találkoznak, amelyeket egymással szemben felmutatnak, és egy táblázatot szerkesztenénk, amelyben azonnal látnánk az anyagok egymással szemben mutatott különbözõ affinitásait.
Ebben a táblázatban azokat az affinitásokat mutatom ma be, amelyeket más vegyészek és magam kísérletei és tapasztalatai alapján gyûjtöttem össze.
Akik a kémia tanulmányozásába kezdenek, ennek a táblázatnak a segítségével rövid idõn belül megfelelõ képet alkothatnak a különbözõ anyagok közötti affinitásokról, és a kémikusok egyszerûen megállapíthatják, mi játszódik le számos mûveletük során, amikor nehéz kideríteni és megjósolni, hogy minek kell keletkeznie a különbözõ anyagok összekeverésekor.

A kötött alkálisók közvetlenül a savak alá kerülnek, mert tudom, hogy semmilyen anyag nem választja el ezeket, ha egyszer egyesültek, másrészt, ha az alsó három anyag közül az egyik egyesül a savakkal, a kötött alkálisók kedvéért elhagyja helyét, mert ezek a sók megjelenésük után közvetlenül egyesülnek a savval.
A harmadik helyen az illékony alkálisók állnak, amelyeknek nagyobb az affinitásuk a savakkal szemben, mint a földszerû anyagoknak vagy a fémeknek, amelyek alattuk vannak, de kisebb, mint a fölöttük levõ alkálisóknak; tehát ha az alsó anyagok közül egyik-másik egy savval egyesül, kiszoríthatja õket, és maga egyesül a savval. Ugyanezeknek az illékony alkálisóknak kisebb az affinitásuk a savakkal szemben, mint a kötött alkálisóknak: így ha a kettõ egyesül, az illékony alkálisóknak nincs rájuk hatásuk; ezzel szemben, ha az illékony alkálisók egyesülnek a savakkal, elhagyják õket a kötött alkálisók jelenlétében, és ezek elfoglalják a helyüket.
Ugyanzet mondhatjuk el a negyedik helyen levõ abszorbens földek esetében. Ezek nem fejtenek ki hatást, ha a kötött vagy az illékony alkálisók egyesülnek a savakkal, s ha ezek a földszerû anyagok egyesülnek a savakkal, ezek a sók helyettesíthetik õket. Ezek az abszorbens földek azonban jobban illenek a savakhoz, mint az alattuk elhelyezett fémes anyagok: tehát ha az utóbbiak egyesülnek a savakkal, átadhatják helyüket az abszorbens földeknek.
Ha a felsõ három anyag bármelyike egyesül a savakkal, az alattuk levõ fémes anyagok nem helyettesíthetik õket, ám a három mindegyike helyettesítheti a savakhoz kötött fémeket.
Mivel a fémes anyagok nem egyformán illenek a savakhoz, például a konyhasó savja felold olyan fémeket, amelyeket a salétromsav egyáltalán nem old stb., a három ásványi savat tettem a következõ három oszlop élére, tehát a konyhasó savját, a salétromsavat és a vitriolsavat [kénsav]. Alattuk minden oszlopba különbözõ fémes anyagokat helyeztem el megfigyelt affinitásuk sorrendjében.
Az ötödik oszlop a különbözõ savak és az abszorbens földek közötti affinitást mutatja.
A hatodik a kötött alkálisók, valamint a savak és a kén közötti affinitásokat tünteti fel.
A következõ oszlopban az illékony alkálisók és a különbözõ savak közötti affinitások szerepelnek.
A nyolcadik a fémes anyagok és a savak közötti affinitásokat mutatja; ezek kissé különböznek a savak és a földek, illetve az alkálisók közötti affinitásoktól. A konyhasó savjának erõsebb az affinitása a fémes anyagokhoz, mint a salétromsavnak vagy a vitriolsavnak, de a földekhez és az alkálisókhoz kisebb az affinitása, mint az utóbbi kettõnek.
A kilencedik oszlop a kéné; itt a különbözõ anyagok a kénnel szembeni affinitásuk sorrendjében helyezkednek el.
A tizedik oszlopba azok az anyagok kerültek, amelyek affinitást mutatnak a higannyal szemben.
A tizenegyedik oszlop az ezüstot és a rezet mutatja az ólommal szembeni affinitásuk sorrendjében.
A tizenkettedikben a higany és a kalamin [cinkvegyületek] rézzel szembeni affinitásai kaptak helyet.
A tizenharmadik a réz és az ólom affinitási sorrendjét mutatja az ezüsttel szemben.
A tizennegyedik az antimon, az ezüst, a réz és az ólom vassal szembeni affinitását tünteti fel.
A tizenötödik a vas, az ezüst, a réz és az ólom antimonnal szemben mutatott affinitását adja meg.
Ebben a két utolsó oszlopban az ezüst, a réz és az ólom ugyanazon a helyen van, mert a Marssal [vassal] vagy az antimonnal szemben mutatott affinitásuk különbsége nem ismert még. ...
Végül a tizenhatodik oszlop a víz affinitását mutatja a szeszekkel és a sókkal szemben.
A következõben a higany-szublimát [higany(II)-klorid] elõállításán – egy igen közönséges, mégis elméletileg alig ismert elõállításon – mutatjuk be, hogyan használható a táblázat annak megállapításában, illetve jóslásában, hogy az egymással vegyülõ anyagok keverékeiben mi játszódik le.
Ezt az elõállítást rendszerint úgy végezzük, hogy csaknem vörösre kalcinált vitriolt [vas-szulfát], rendkívül deflegmált [szárított], dekrepitált [széttört] konyhasót és salétramsavban oldott higanyból készített, szárazra párolt, salétromos higanysót veszünk. Ezt a három anyagot jól összekeverjük, mire a salétromsav szaga azonnal érezhetõvé válik, és sárga gõzök emelkednek föl. Ha a keveréket gyenge tûzön desztilláljuk egy retortában, sav fejlõdik, amely elsõsorban salétromsav a konyhasó egy kevés savjával összekeverve, ami gyenge királyvizet tesz ki. Ha a tüzet fokozzuk, fehér, kristályos, sós anyag emelkedik a retorta tetejére, míg alul vöröses anyag marad vissza; ebbõl kilúgozással fehér sót és vörös fémes földet [fém-oxidot]választhatunk el.
Amint látni fogjuk, az így kapott anyagok nagymértékben különböznek a felhasznált anyagoktól.
A felhasznált vitriol olyan só, amely vitriolsav és vitriolsavban oldott vas erõs egyesülésébõl származik. A konyhasó ugyancsak só, amely a só savjának és egy abszorbens földnek az erõs egyesülésébõl keletkezik. A salétromos higanysó salétromsav és higany egyesülésének eredménye.
Meg kell vizsgálnunk annak a hat anyagnak az affinitását, amelybõl ez a három keverék keletkezik, hogy megállapíthassuk, miként reagálnak egymással.
Látom, hogy ez a három keverék különbözõ savas sókból áll, amelyek közül az egyiknek, a konyhasó savjából készült sónak az alapja abszorbens föld, míg a másik kettõnek, vagyis a vitriolsavas és a salétromsavas sónak fémes anyag az alapja. Táblázatom elsõ oszlopában azt találom, hogy a savaknak általában nagyobb az affinitásuk a konyhasó abszorbens földjével szemben, mint a vassal és a higannyal szemben, míg az ötödik oszlopból azt olvasom ki, hogy a vitriolsav nagyobb affinitást mutat az abszorbens földdel szemben, mint akár a salétromsav, akár a konyhasó savja, amellyel a föld egyesült már. Ebbõl – feltevésemet követve – megállapítom, hogy a vitriolsavnak el kell hagynia a fémjét, hogy a konyhasó földjéhez kapcsolódjon. Ez valóban le is játszódik. A konyhasó savja eltávozik a vitriolsav közeledtére, és mivel természeténél fogva illékony, a levegõben árad szét, ha nem érintkezik a fémes anyagokkal, amelyekhez nagyobb az affinitása, mint a többi savnak, amint a nyolcadik oszlopból kiderül. Ekkor mind a vitriol vasát, mind salétromos higanyt megtámadja.
Mivel a konyhasó savja jobban illik a higanyhoz, mint a salétromsav, arra készteti az utóbbit, hogy hagyja ott a higanyt. A salétromsav szabaddá válik, és semmit sem talál, amihez kötõdhetne: a levegõbe távozik, s vöröses vagy sárgás gõzök formájában hagyja el az edényt.
Ugyanakkor a konyhasó savja a higanyhoz kötõdik, egy másik és sokkal nagyobb rész a vassal vegyül, és ott is marad, amíg a tûz ereje, amelyet a szublimálás során megnöveltünk, arra nem készteti a savnak ezt a részét, hogy váljon el a vastól, amely túlságosan kötött ahhoz, hogy felemelkedjen; ez a tûzzel felszabadított sav találkozik a higanyos részekkel, amelyek még nem váltak el teljesen a salétromsavtól, csatlakozik hozzájuk, és teljesen eltávolítja a salétromsavat, amely sárgás gõzökként oszlik szét, miközben a konyhasó savja és a higanyos részek vegyülése olyan sós, higanyos konkréciót alkot, amely elgendõen illékony ahhoz, hogy fölemelkedjen, vagy (ahogy a kémikusok mondják) az edény tetejére szublimáljon – ezért nevezik higany-szublimátnak.
A vöröses vagy sárgás gõzök elsõsorban nitrózus gõzök. Véleményem szerint ez jórészt az a salétromsav, amely a konyhasó savjának hatására elvált a higanytól, mert a konyhasó savjának egy kis részét is felûzi a retorta tetejére az erõs tûz, és ez a sav nem térhet vissza a szilárd maradékhoz.
Az edény alján vöröses anyag marad; ez fémes föld vagy Mars sáfránya, amely a mûvelet elõtt egyesült a vitriolsavval, melytõl most elvált. A vitriolsav elhagyta a fémet, és a konyhasó földjéhez kapcsolódott, s együtt olyan sót alkottak, amelyet most is összetévesztenek a Mars sáfrányával anélkül, hogy bármi köze lenne hozzá. Ezt a sót nagyon könnyen elválaszthatjuk kilúgozással; természete megegyezik Glauber csodálatos sójának természetével [nátrium-szulfát]. A kolkotár vagy Mars sáfránya [vas(III)-oxid] a kilúgozás után teljesen megszabadul a savjától, ha a sóból épp csak az elegendõ mennyiséget használtuk.
Ebben a mûveletben a salétromsavnak a vasnak azokhoz a részeihez kell kötõdnie, amelyeket a vitriolsav elhagyott, feltéve, hogy az erõs hõ nem szórta szét a savrészecskéket és nem hajtotta õket ki az edénybõl.
Világos tehát, hogy a salétromsav semmilyen célt nem szolgál ebben a mûveletben, hiszen elhagyja a higanyt és elmenekül – egyik anyaggal sem reagál. Néhányan nem is oldják fel a higanyt salétromsavban. Õk egyszerûen összekeverik a vitriolt, a konyhasót és higanyt, ahogy van, s a szublimáció ugynúgy lejátszódik. Meg kell azonban jegyezni, hogy ebben a mûveletben sokáig kell porítani az anyagot, hogy jól elporladjon és bensõségesen el kell keverni. Ez a mûvelet fárasztó és a porítás közben felpattanó darabok veszélyesek is. Ha azonban a higanyt feloldjuk a salétromsavban, a fém nagyon jól el van oszlatva az oldás hatására, és sokkal jobban elõ van arra készítve, hogy azonnal és bensõségesen egyesüljön a konyhasó savjával.
A salétromsav használata mellett szól az is, hogy a közfelfogás szerint a salétromsav a konyhasó savját gyengíti és sokkal illékonyabbá teszi; ezzel olyan állapotba hozza, hogy erõsebben egyesülhet a higannyal – ugyanígy a konyhasó savja, amely önmagában alig oldja az aranyat, egy kevés salétromsavval élénkítve már gyorsan feloldja a fémet. Néhányunk véleménye szerint ez a salétromsavban levõ, igen szubtilis kénes princípium hatására megy végbe, amely a salétromsavból átadódik a konyhasó savjának. Most azonban nem fejthetjük ki ezt a témát. Elegendõ annyit mondanunk, hogy a szublimáció végrehajtható salétromsavval vagy anélkül, és gyorsabban lejátszódik, ha a higanyt a salétromsav szétoszlatja, s kevésbé könnyen megy végbe, ha nincs szétoszlatva.
Egy másik megfigyelés szerint elhagyhatjuk a vitriolt, ha a higanyból salétromsavval sót képezünk. Ha tiszta, folyékony higanyt használunk vitriol nélkül, a mûvelet kudarcot vall. Felfogásunk fényében az ok teljesen világos. A konyhasó savja, amelynek a földhöz nagyobb az affinitása, mint a fémes anyagokhoz, amint az elsõ oszlop mutatja, nem mozdul el, hogy a higanyhoz kapcsolódjon, hacsak nem késztetik erre. Önmagában egyáltalán nem támadja meg a higanyt. De ha olyan sót használunk, amelyet a salétromsav képezett a higanyból, a salétromsavnak nagyobb affinitása lesz a konyhasó földjéhez, mint a só savjának, amint az ötödik oszlopból kitûnik, és ugyanennek a salétromsavnak nagyobb lesz az affinitása a földdel szemben, mint a higannyal szemben, amint az elsõ oszlopból látszik, ezért megindul a reakció. A salétromsav elhagyja a higanyt, hogy a só földjéhez kapcsolódjon, így a földrõl leválik a sav. A konyhasó savja tehát megszabadul a földjétõl, találkozik a felszabadult higannyal, társul vele, és ez a két anyag alkotja együtt azt a szublimát-vegyületet, amely felemelkedik az edény tetejére. Közben a salétromsav és a konyhasó földje sót képez, amely az edény alján marad; ez a só jó salétrom.
Egyesek úgy készítik a higany-szublimátot, hogy a higanyt salétromsavban oldják, és konyhasó vizes oldatát adják hozzá, ami fehér csapadékot képez. Amikor a folyadék kitisztul, dekantálják, és a fehér port, amely az edény alján van, elválasztják. Ez a fehér higanycsapadék. Megszárítják, majd kompakt, fehér, sós anyaggá szublimálják: ez a higany-szublimát.
Ha a dekantált, tiszta folyadékot elpárologtatják, nagyon jó salétromot kapnak.
Ennek a mûveletnek az elmélete ugyanaz, mint az elõzõé; itt oldatban megy végbe, ott száraz anyagokkal.
A salétrom mindkét esetben elhagyja a higanyt, amelyet oldódáskor megragadott, és a konyhasó földjéhez köti magát; közben felszabadítja ennek a sónak a savját, amely ezután a higanyhoz kötõdik, és fehér porként csapódik ki. A tûz a port felemeli, és fehér só keletkezik.
...
Bár ez a táblázat meglehetõsen sok anyag affinitását hasonlítja össze, nem kétlem, hogy sok másik anyaggal bõvülhet, ha affinitásaikat kísérlettel meghatározzák.
Ha helyénvalónak találják, késõbb az összes olyan kísérletet ismertetem, amelyen a táblázatban található különbözõ anyagok affinitásai alapulnak, és amelyek alapján az itt látható módon rendeztem el az anyagokat.
Meg kell jegyeznem, hogy sok kísérletben az anyagok elválasztása nem egészen tökéletes. Ennek több oka van, amelyet lehetetlen kiküszöbölni; ilyen például a folyadék viszkozitása, mozgása, a kicsapandó anyag vagy a csapadék jellege, és más olyan dolgok, amelyek megakadályozzák az összes rész azonnali kicsapódását vagy pontos elválasztását. Ezek a hibák azonban nem olyan nagyok, hogy a szabályokat ne tekinthetnénk állandónak.
| Klasszikus cikkek | http://www.kfki.hu/chemonet/
http://www.chemonet.hu/ |