| Ar3CX |
(1) |
Karbokation-kutatásaim, a karbokationok
szerepe a kémiában
Oláh György Nobel-elôadása
1994. december 8-án
A szénhidrogének szénbôl és hidrogénbôl álló vegyületek. Ezekbôl épül fel a földgáz és a kôolaj, alapját képezik a modern életnek. Elégetésükkel energiát termelünk erômûveinkben, és fûtjük otthonainkat is. Gázolajszármazékok és dízelolaj hajtják a személy- és tehergépkocsikat és repülôgépeket. Gyakorlatilag minden mesterséges anyagnak szénhidrogének képezik az alapját, a mûanyagoktól a gyógyszerekig. A természet adományát azonban használat céljára át kell alakítanunk; ma már a szénhidrogéneket is magunknak kell elôállítani, mivel a természetes források kimerülôben vannak. Az eljárások legtöbbjénél savas katalízist alkalmaznak még olyan kémiai reakciókban is, ahol pozitív ion a közbensô termék. Ezért van nagy jelentôsége annak, hogy a közbensô termékeket és azok kémiáját mind alapkutatási, mind gyakorlati szempontból tanulmányozzuk.
A karbokationok a szénvegyületek pozitív ionjai.
1901-ben Norris és Kehrman egymástól
függetlenül fedezte fel, hogy a színtelen trifenil-metanol
tömény kénsavban oldva sötétsárga
színû lesz. Hasonlóképpen a trifenil-metil-klorid
az alumínium- és ón-kloriddal narancsszínû
komplexvegyületet képez. Von Baeyer ismerte fel 1902-ben
(Nobel-díj, 1905) azt, hogy sójellegû vegyületek
képzôdték a következô egyenlet értelmében:
| Ar3CX |
(1) |
Megpróbált összefüggést találni a szín megjelenése és a sóképzôdés között (ezt a jelenséget nevezik halokrómiának). Gomberg (aki nem sokkal korábban fedezte fel ezt a stabil trifenil-metil gyököt) és Walden kutatásai alapján értették meg ezeknek a színezékeknek, például a malachitzöldnek a szerkezetét [1].
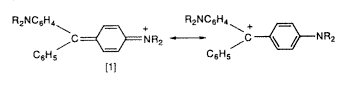
Nem sokkal késôbb a természetben is ráakadtak karbokationos színezékekre. A vörösbor, valamint sok virág, gyümölcs, levél stb. színe részben a megfelelô glükozidok felhasadásakor képzôdött flavilium- és antocianinvegyületeknek tulajdonítható.
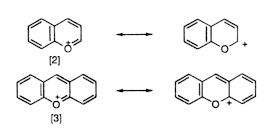
Az említett flavilium- és antocianinvegyületek felépítését Robinson és Willstätter úttörô munkássága alapján ismerték meg. Werner a rokon benzopirilium- és xantiliumsók szerkezeti formuláját ([2] és [3]) oxóniumsókként rajzolta meg, míg Baeyer a triaril-metilium-sókhoz való hasonlóságukat emelte ki, és ezeket karbéniumsóknak tekintette. Késôbb mindkét nézet igazolást nyert, és megállapították mind az oxónium-, mind a karbokation rezonanciaformulája hozzájárulásának a jelentôségét.
1922-ben Hans Meermein, miközben a kamfén-hidrokloridnak [4] izobornil-kloriddá [5] való Wagner-féle átrendezõdését tanulmányozta, azt találta, hogy a reakciósebesség nôtt az oldószer dielektromos állandójának növekedésével.
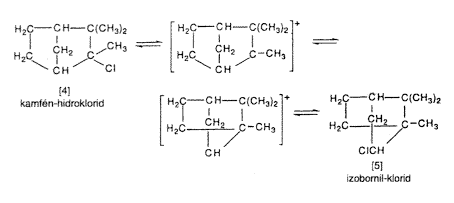
Azt is megállapította, hogy egyes klorid Lewis-savak, például az SbCl5, SnCl4, FeCl3, AlCl3 és SbCl3 (BCl3 és SiCl4 azonban nem) és a száraz HCl (amely karbokationos komplexképzôdéssel elôsegíti a trifenil-metil-klorid ionizációját) jelentôsen gyorsítják a kamfén-hidroklorid átrendezôdését izobornil-kloriddá. Meerwein azt a következtetést vonta le, hogy az izomerizáció tulajdonképpen nem a klóratom vándorlásán keresztül megy végbe, hanem egy közbensô kationvegyület ([4] és [5]) átrendezôdésével.
Így született meg a karbokationos közbensô termékek modern felfogása. Meerwein nézeteit azonban Németországban a kortársak kétkedéssel fogadták, és elvették a kedvét attól, hogy folytassa kutatásait.
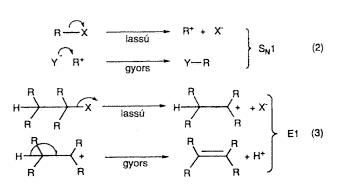
Angliai munkatársai, C.K. Ingold és E.H. Hughes a húszas évek végén kezdtek elmélyültebben foglalkozni azokkal a kinetikus és sztereokémiai vizsgálatokkal, amelyeket késôbb telített szénatomokon végbemenô nukleofil szuszbtitúciós és poláris eliminációs reakciók néven ismertek meg. Az SN1 és E1 reakcióknak nevezett monomolekuláris nukleofil szubsztitúcióra és az eliminációra vonatkozó munkáik (2. és 3. egyenlet) derítették fel azt, hogy a szerves reakciókban milyen szerepet játszanak az elektronhiányos karbokationos közbensô termékek.
Az Egyesült Államokban F. Whitmore a harmincas években közzétett cikksorozatában általánosította ezt a fogalmat sok más szerves reakcióra is. A karbokationokat általában instabil, átmeneti (rövid élettartamú) közbensô termékeknek tartották, mivel nem lehetett azokat közvetlenül megfigyelni. Sok kiváló vegyész, köztük Roger Adams is erôsen kételkedett abban, hogy ezek mint valódi intermedierek léteznek, és még a nevüket sem voltak hajlandók kiejteni. Whitmore se volt képes elérni, hogy a Journal of the American Chemical Societyben megjelent cikkeiben használhassa az ionos R3C+ jelölést. Beérett azonban a széles körben tanulmányozott reakciók kinetikája, a sztereokémiai ismeretek bôvülése és a reakciótermékek vizsgálata nyomán a karbokation név elfogádása. A modern karbokation-kémia fejlôdéséhez sok nagy kutató járult hozzá, többek között F.D. Bartlett, C.D. Nenitzescu, S. Winstein, D.J. Cram, M.J.C. Dewar, J.D. Roberts, P.v.R. Schleyer. Véglegesen elismerték a karbokationok szerepét, elfogadták és számosan ismertették mint a modern kémia egyik alapvetô fogalmát.
Tömegspektroszkópiai adatokkal bizonyították a gáznemû karbokationok létezését, de sem szerkezetükre, sem oldódásuk kémiájára nem tudtak ezekbôl következtetni. Távolinak látszott direkt észlelésük, valamint az, hogy tanulmányozhassák a stabil, hosszú élettartamú karbokationokat vagy pedig a folyadékfázisú alkilkationokat.
Az ötvenes években kerültem kapcsolatba a karbokationok
tanulmányozásával, ekkor sikerült közvetlenül
észlelni alkilkationokat és erôsen savas (szupersavas)
oldatokban a hosszú élettartamú karbokationok egész
sorát. A hozzájuk tartozó anionok (SbF6,
SbF11 stb.) gyenge nukleofil jellege nagyban hozzájárult
a karbokationok stabilitásához, és ezeket bizonyos
körülmények között kristályos sók
formájában is ki lehetett nyerni. A kifejlesztett szupersavas
"stabilion-módszert" azután alkalmazni lehetett más
ionos közbensô termékek (nitrónium, halónium,
oxónium stb. ionok) elôállítására.
Egyre több karbokation elôállítása és
tanulmányozása tette lehetôvé a karbokation-fogalom
általánosítását, amit én vetettem
fel egy 1972-ben megjelent cikkemben én javasoltam azt is, hogy
a szénvegyületek kationjaira a "karbokation" nevet használjuk.
A szénvegyületek kationjaira a IUPAC ezt a nevet az általánosan
elfogadott elnevezések közé sorolta, ugyanígy
elfogadták az anionos vegyületekre a "karbanion" nevet is.
Az acilkationoktól az alkilkationokig
A karbokationoknak a reakciók során tapasztalt átmeneti jellege a rendszerben jelen levô erôs nukleofilekkel szembeni nagy reakcióképességükbôl származik. Az aránylag gyengén nukleofil ellenionok, fôleg a tetrafluoro-borát (BF4) felhasználásával érte el Meerwein a negyvenes években, hogy sikerült egy sor oxónium- és karboxóniumiont tartalmazó sót, például R3O+BF4-et és HC(OR3)+X-t elôállítania. Ezek a Meerwein-sók hatásos alkilezõszerek, és az SN2-típusú reakciókban alkilcsoportokat szolgáltatnak, másrészt viszont a Meerwein-féle vizsgálatok során nem kaptak (RCO+BF4) acil- vagy (R+BF4) alkilkation-tartalmú sókat.
Bebizonyították már, hogy az ecetsav vagy az ecetsavanhidrid
olyan Lewis-savakkal, mint a bór-trifluorid, komplexeket képez.
Alaposan tanulmányozták ezenkívül az ecetsav
és az ecetsavanhidrid viselkedését erôsen protikus
(protogén) savakban (kénsav, óleum, perklórsav
stb.), nem sikerült azonban ezekbôl az acetilkationt (vagy valamelyik
homológ acilkationt) izolálni vagy egyértelmûen
kimutatni. Elôször F. Seel készített 1943-ban
acetilium-tetrafluoro-borátot úgy, hogy az acetil-fluoridot
bór-trifluoriddal reagáltatta (4. egyenlet)
| CH3COF + BF3 |
(4) |
Az ötvénes évek elején a Budapesti Mûszaki
Egyetem Szerves Kémiai Intézetében dolgoztam, melyet
a néhai
Zemplén Géza
professzor a neves szénhidrátkémikus Emil Fischer
(Nobel-díj, 1902) egykori tanítványa vezetett; én
az ô "tudományos unokájának" tekintem magamat.
Itt kezdtem érdeklôdni a szerves fluorvegyületek iránt.
Zemplén nem várt sokat ettôl, mivel azt gondolta, hogy
próbálkozásom a fluorvegyületek vizsgálatával
mivel speciális reagenseket igényeltek hóbortos
ötlet. Én azonban kitartottam, és így sikerült
elérnem, hogy átengedték nekem a kémiai épület
egyik nyitott erkélyét, amelyet én korábbi
publikációmból ismert munkatársaimmal (A.
Pavlath, S. Kuhn) laboratóriummá alakítottam
át, és elkezdtünk kísérletezni a szerves
fluoridokkal.
Seel egyik korábbi közleménye különösen
nagy hatással volt rám. Zemplén érdeklôdési
területe a glükozidszintézis és a szénhidrátkémia
volt, ezért arra gondoltam, hogy az alfa- vagy béta-glükozid
szintézisét a megfelelô aglikonnak aceto-fluor-glükózzal
(illetve más fluortartalmú szénhidráttal) vagy
pedig az aglikonnak a viszonylag stabil dezacetilezett fluorhidrinjével
való reagáltatásával hajtom végre. A
terveimhez COF-vegyületekre volt szükségem. Úgy
látszott, hogy Seel nem folytatja vizsgálatait, ezért
elkezdtem érdeklôdni az acil-fluoriddal történô
acilezés iránt. Munkámat ezután kiterjesztettem
az alkil-fluoriddal való alkilezésre, amikor a FriedelCrafts-reakciókhoz
katalizátorként bór-trifluoridot használtam.
Ezek a vizsgálatok felkeltették érdeklôdésemet
a reakciók mechanizmusa iránt ideértve az RCOF és
RF komplexét BF3-mal, majd más fluorid Lewis-savakkal
(5. és 6. egyenlet). Így kezdôdött el az én
hosszan tartó kapcsolatom a karbokationos komplexek kémiájával.
| BF3 | |||||||
| ArH | + | RCOH | > | ArCOR | + | HF | (5) |
| ArH | + | RF | BF3
> |
ArR | + | HF | (6) |
A háború utáni Magyarországon nem volt könnyû ezeket a kutatásokat folytatni. Nem juthattunk hozzá olyan vegyszerekhez, mint a vízmentes HF, FSO3H vagy BF3 ezeket magunknak kellett elôállítani. HF-et folypátból és kénsavból készítettünk, majd reagáltattuk az (óleumból kapott) SO3-mal, az eredmény az FSO3H volt. Bórsav és fluor-kénsav reakciójával BF3-at kaptunk. Valódi merészség volt a legelemibb felszerelést nélkülözô laboratóriumban ezekkel az anyagokkal dolgozni, és velük kémiai reakciókat végezni. 1955-ben Meerwein, aki olvasta néhány cikkemet, volt olyan szíves, hogy elkezdett velem levelezni, és felajánlotta segítségét így kaptunk egy palack BF3-gázt. Micsoda értékes ajándék volt ez!
Az acil-fluoridokkal végzett korai munkásságom kiterjedt a formil-fluoridra (HCOF), amelyet elôször Nyeszmejanov állított elô a harmincas években, de ô nem használta fel szintézishez. Mi viszont az acil-fluoridok számos homológját készítettük el, és tanulmányoztuk azok kémiáját.
A FriedelCrafts-kémiából ismeretes, hogy ha pivaloil-kloridot alumínium-klorid jelenlétében aromás vegyületekkel hozunk össze, akkor a várt ketonok mellett a terc-butil-vegyületek is megjelennek (7. egyenlet).
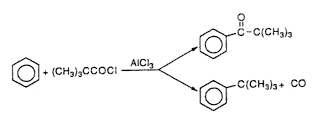 (7)
(7)
Feltételezték, hogy az utóbbi képzôdése
együtt jár a közbensô pivaloil-komplex vagy -kation
dekarbonilezésével. Az ötvenes évek végén,
amikor már Kanadában, a Dow Chemical Company laboratóriumában
(Sarnia, Ontario) dolgoztam, visszatérhettem ezekhez a vizsgálatokhoz,
és az IR- és NMR-spektroszkópia felhasználásával
kiterjesztettem az acil-fluorid Lewis-savak izolálható
savas fluorid-komplexeire ideértve az olyan több vegyértékû
fluorid Lewis-savakat, mint az SbF5, AsF5, PF5.
Ezért nem ért váratlanul, amikor az elôállított
(CH3)3CCOFSbF5 komplex hajlandóságot
mutatott dekarbonilezôdésre. Az volt inkább izgalmas,
hogy a folyamatot követni tudtuk NMR-spektroszkópiával,
és sikerült észlelnünk az elsô stabil, hosszú
élettartamú alkalilkation-tartalmú sót, a terc-butil-hexafluoro-antimonátot.
| (CH3)3CCOF + SbF5 > (CH3)3CCO+SbF6 | CO
> |
(CH3)3C+SbF6 | (8) |
Ezt az áttörést az 1962-ben megjelent cikkeimben
közöltem, és folytattam a kutatásokat, melyek eredményeképpen
kidolgoztam annak a módszerét, hogy hogyan lehet hosszú
élettartamú alkilkationokat oldatban elôállitani.
Mielôtt áttérnék ennek az izgalmas fejlôdésnek
a tárgyalására, röviden áttekintem keresgéléseimet
ezek után a sokszor csalókának tûnô alkilkationok
után.
Az elsô korai sikertelen kísérletek az alkilkationok észlelésére oldatokban
A hatvanas évek elejéig az alkilkationokat átmeneti jelenségeknek tekintették. Létezésükre indirekt módon következtettek a kinetikai és sztereokémiai vizsgálatok alapján. Több évtizedes kutatások (beleértve a vezetôképességi és krioszkópos méréseket) után sem sikerült oldatban, vagy szilárd fázisban jelen levô egyszerû alkilkationokra spektroszkópiai vagy más fizikai mérési adatokat publikálni. Az ötvenes évektôl vizsgálták tömegspektroszkópiai módszerrel alkánok, alkil-halogenidek és más prekurzorok elektronbombázásával keletkezett gázállapotú alkilkationjait ezek a vizsgálatok természetesen nem szolgáltattak szerkezeti információkat.
Megfigyelték a FriedelCrafts-féle alkil-halogenid Lewis-sav halogenid-komplexek létezését; ugyanezt igazolták Brownnak a CH3Cl-nek és a C2H5Cl-nek a gallium-klorid jelenlétében végbemenô gôznyomás-csökkenésére vonatkozó vizsgálatai. Mérték alumínium-klorid vezetôképességét alkil-kloridokban, alkil-fluoridokét bór-trifluoridban, és vizsgálták az etil-bromid hatását az alumínium-bromid dipólmomentumára, de nem sikerült egy esetben sem jól definiált, stabil alkilkation-komplexek jelenlétének egyértelmû kimutatása, vagy ezek elôállítása még nagyon alacsony hômérsékleten sem.
Rosenberg és Symons alkoholok és olefinek elektronspektrumát vette fel olyan erôs protikus savakban, mint a kénsav. Azt figyelték meg, hogy számos egyszerû alifás alkohol és olefin abszorpciós maximuma 290 nm körül van, és ezt a karakterisztikus abszorpciót az alkil-kationoknak tulajdonították. Finch és Symons újabb mérései azt mutatták, hogy a spektrum nem az egyszerû alkilkationoktól, hanem az ecetsavval a prekurzor alkoholok és olefinek oldószerével képezett kondenzációs termékektõl származik. Azonosítottak még abszorpciós komponensként protonált mezitil-oxidot az izobutén-ecetsav-kénsav rendszerben.
Deno és munkatársai mélyrehatóan tanulmányozták, hogy mi történik a hígítatlan kénsavban, illetve óleumban, alkoholokból és olefinekbôl képzôdött alkilkationokkal, és azt találták, hogy egyenlô mennyiségben termelôdik kénsavban oldhatatlan telített szénhidrogénelegy (C4-tôl C18-ig), és ciklopentenilkationok elegye (C9-tôl C20-ig) a kénsavas fázisban. Ezeknek a kationoknak erôs UV-abszorpciójuk van 300 nm körül.
Olah, Pittmann és Symons ezután megmagyarázta és összefoglalta a karbokationos rendszerek elektronspektrumának problémáját és a különbözô prekurzorok szerepét egyes savakban.
Ebben a szakaszban derült ki, hogy a korábbi kísérletek
a hosszú élettartamú, jól definiált
alkilkationok létezésének kimutatására
olyan savakban, mint kénsav, perklórsav stb. nem lehettek
sikeresek, és legjobb esetben csak bizonytalan eredményt
adtak az alkil-halogenideknek Lewis-savakkal való kölcsönhatására
vonatkozóan. Proton eliminációja az olefinképzôdéssel
járó, közbensô termékként kialakuló
alkilkationokból, amelyek tovább reagálnak, elôsegíti
a vezetôképességet befolyásoló komplex
rendszerek létrejöttét és egyéb kémiai
és fizikai jelenségek tanulmányozását.
A szupersav-kémia területén lezajlott áttörésig
nem tudták elképzelni, hogy ha vissza akarják szorítani
a deprotonálással végbemenô olefinképzôdést
alkilkationokból (9. egyenlet ekkor nagyon bonyolult rendszerek
keletkeznek, olefinekbôl és alkilkationokból, olyan
reakciókban, mint az alkilezés, polimerizáció,
gyûrûzáródás stb.), úgy az akkori
idôkben ismerteknél és használtaknál
sokkal erôsebb savakra van szükség.
| (CH3)3C+ |
(9) |
Ezeknek a szupersavaknak elnevezett savaknak a felfedezése
vezetett oda, hogy képesek lettünk elôállítani
stabil, hosszú élettartamú alkilkationokat és
általában karbokationokat. Ha viszont, akár csak korlátozott
egyensúlyi körülmények között is, deprotonálás
megy végbe, akkor az alkilkation (mint erôs sav) azonnal kölcsönhatásba
lép az olefinnel (amely jó bázis), és az említett
reakciók sokasága megy végbe.
Alkil-fluoridból képzôdô, hosszú élettartamú alkilkationok antimon-pentafluoridban és a megfelelô konjugált szupersavakban
Az ötlet, hogy stabil alkilkationokat lehet nyerni alkil-fluoridok
ionizációjával, ha feleslegben vannak jelen oldószerként
erôs fluorid Lewis-savak, még azoknak a vizsgálatoknak
a folyamán keletkezett, amikor még az ötvenes évek
elején Magyarországon dolgoztam, és aromás
anyagoknak alkil-fluoridos alkilezéséhez bór-trifluoridot
használtam katalizátorként. Ekkor kísérleteztem
RF:BF3 komplexek elôállításával.
Világosan láttam, hogy nehéz olyan megfelelô
oldószert találni, amely lehetôvé teszi az ionizációt,
de ugyanakkor nem lép kölcsönhatásba a keletkezô
és feltehetôleg rendkívül reakcióképes
alkilkationokkal. Ezért reagáltattam alacsony hômérsékleten
tiszta alkil-fluoridokat bór-trifluoriddal. Ekkor még nem
álltak rendelkezésemre (az akkor még gyermekcipôben
járó) IR- és NMR-spektroszkópiai módszerek.
Visszaemlékszem Costin Nenitzescu egyik látogatására.
Ô kiváló, de igazán soha el nem ismert román
kémikus volt, aki sok úttörô eredményt
ért el a savas katalízissel végbemenô reakciók
területén. Együtt siránkoztunk azon, hogy miért
nincs nekünk még egy IR-spektrométerünk sem. (Késôbb
hallottam tôle azt a történetet, hogy amikor Bécsbe
utazott egy kollégájához az Orient-expresszen, az
IR-vizsgálatok céljából magával vitt
ciklobutadién-Ag komplex elbomlott.) Ebben az idôben a mi
RF-BF3 rendszerünk vizsgálatához csak vezetôképességi
méréseket tudtunk végezni. Kiderült, hogy a metil-fluorid
és az etil-fluorid komplexeinek a vezetôképessége
kicsi, míg az izopropil-fluoridéi és a tercier-butil-fluoridéi
nagyon jó vezetôk (10. egyenlet). Az utóbbi rendszerek
azonban bizonyos mértékig hajlamosak voltak a polimerizációra
(az ott szereplô, olefinképzô karbokationok deprotonálódása
miatt). Ezek szerint a savképzôdés van hatással
a vezetôképességre.
| RF | + | BF3 | d+
RF |
> | d
BF3 |
R+BF4 | (10) |
Az 1956-os magyarországi forradalom leverése után családommal elmenekültem, és néhány hónapos londoni tartózkodás után Kanadába költöztem, ahol a Dow Chemical Company Kutató Laboratóriumában (Sarnia, Ontario) folytathattam kutatásaimat. Sokáig és kitartóan keresgéltem a halogenid Lewis-savak között, és végre rátaláltam az antimon-pentafluoridra. Kiderült, hogy ez rendkívül erôs Lewis-sav, így sikerult elsô alkalommal alkil-fluoridokat ionizációval stabil, hosszú élettartamú alkil-kationokká alakítani. A tiszta SbF5-oldatok viszkózusak, de folyékony kén-dioxiddal hígítva lehûthetôk, és így egészen 78 oC-ig lehet azokat vizsgálni (késôbb még erôsebben nukleofil oldószereket is használtam, amelyekkel még alacsonyabb hômérsékletre is le lehetett menni). Tovább folytatva a pivaloilkationok dekarbonilezôdésének említett megfigyelését, megkaptuk az elsô spektrális bizonyítékot a tercier-butil-kation létezésére, feleslegben lévô antimon-pentafluoridban ionizáltuk a terc-butil-fluoridot. A tercier-butil-kation oldata nagyon stabilnak bizonyult, és lehetôvé vált a kémiai és spektroszkópiai tanulmányozása.
Az ötvenes évek végén a kanadai Dow-laboratórium
kutatási igazgatója még nem volt meggyôzôdve
az NMR-spektroszkópia hasznosságáról, ezért
nem volt még saját készülékünk. A
Midlandben (Michigan), a határon túl, tôlünk körülbelül
100 mérföldre fekvô Dow-laboratóriumban szerencsére
volt, és a kitûnô berendezést E.B. Baker,
az NMR-spektroszkópia egyik úttörôje üzemeltette,
aki felajánlotta segítségét. Rendszeresen átjártunk
a mintáinkkal a kora reggeli órákban Midlandbe, hogy
meggyôzôdjünk arról, hogy az alkil-fluoridok antimon-fluoridos
oldata valóban tartalmaz-e alkilkationokat, és figyeltük,
hogyan veszi fel Ned Baker az NMR-spektrumot. Maga a terc-butil-fluorid
az 1H-NMR-spektrumban karakterisztikus dublettet ad, amely egy
JHF 20 Hz-es fluor-hidrogén csatolásnak tulajdonítható.
SbF5-oldatban a dublett eltûnik, a protonok árnyékoltsága
jelentôsen csökken, d 1,3-ról
4,3-ra nô. Ez nagyon bíztató volt, de még nem
bizonyította teljesen a terc-butil-kation jelenlétét.
Ha feltételezzük azt, hogy a tercier-butil-fluorid az SbF5-tel
csak olyan poláros donor-akceptor-komplexet képez, amelyben
(NMR-idôskálán mérve) gyors fluorcsere megy
végbe, akkor a fluor-hidrogén csatolás "kimosódik",
miközben várható, hogy a metil-protonok árnyékoltsága
erôsen csökken. Nagy kihívás volt, hogy megkülönböztethessük
a poláros, gyorsan cserélô donor-akceptor-komplexet
az oly mohón keresett valódi ionos t-C4H9SbF6-tól
(11. egyenlet).
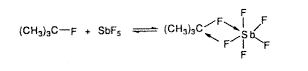 |
(11) |
| vagy (CH3)3C+ SbF6 |
Ned Baker fizikus volt, ennek ellenére nagyon érdekelték a kémiai problémák. Ajánlott egy módszert arra, hogy a híg oldatainkban hogyan vegyük fel a C-13-spektrumot, ami akkor a Fourier-transzformációs NMR-technika megjelenése elôtt rendkívül nehéz feladatnak számított. Ebben az idôben a C-13-jelzett-atomos módszert (a használt Ba13CO3-mal) csak körülbelül 50 %-ig lehetett alkalmazni. Amikor 50 %-os C-13-mal jelzett tercier-butil-fluoridot készítettünk, akkor ez a legjobb esetben is csak 5 %-os SbF5-oldatot jelentett, azaz az oldat C-13-tartalma erôsen felhígult. Baker azonban nem tágított, és az INDOR-módszert ajánlotta (INDOR = inter nuelear double resonance). A protonjel nagy érzékenysége alapján a kettôsrezonancia-technikával képes volt észlelni a mi híg oldatainkban a C-13-eltolódást (1960-ban ez jelentôs eredmény volt). Érthetô volt az örömünk, amikor kiderült, hogy a (CH3)3CFSbF5-ben a tercier-szén-eltolódás (d 13C 335,2) nagyobb volt, mint 300 ppm különválasztva a kovalens kiindulási anyagunktól! Ilyen nagy kémiai árnyékhatás-megszüntetés nem volt magyarázható csupán donor-akceptor komplex jelenlétével (akkoriban a legnagyobb C-13 árnyékhatás-megszüntetô jel volt ez). Ez sp3-ról sp2-re való rehibridizációra, valamint a karbokationos szénatomon jelen lévô jelentékeny pozitív töltésre utalt. Nem tárgyalom részletesen az ellenion jellegét (ez lehet dimer-, vagy esetleg oligomer-Sb2F11), sem az ionpárosítást vagy -szeparálást (ezek a fogalmak Winsteintôl származnak).
A terc-butil-kationon kívül sikerült elôállítani
és tanulmányozni a megfelelô szek-izopropil-
és terc-amil-kationt is (12. és 13. egyenlet).
| (CH3)2CHF + SBF5 > (CH3)2CH+ SbF6 | (12) |
| (CH3)2CFCH2CH3 + SBF5 > (CH3)2C+CH2CH3SbF6 | (13) |
Különösen az izopropil-kation volt érdekes. Míg a terc-butil-kationban a metil-protonok olyan szénhez kötôdnek, amelyek csupán szomszédosak a központi karbokationnal, addig az izopropilkationban közvetlenül hozzá kötôdnek. Az i-C3H7F-SbF5 rendszer proton-NMR-spektrumában a CH-protonra egy erôteljesen árnyékolatlan szeptettet találtunk d 13,5-nél, ami kizárta a polarizált donor-akceptor komplex jelenlétének lehetôségét, és azt jelezte, hogy (CH3)2CH+ keletkezett. A C-13-spektrum szintén bizonyító erejû volt, mivel nagyon erôsen árnyékolatlan (>300 ppm-nél) +C kémiai eltolást (d 13C 320,6) mutatott. Másik érdekes jelenség volt, hogy a terc-amil-kationnál megfigyelhettük a karbokation-középponttal szomszédos metil-proton széles tartományú, erôs H-H-csatolását a metilén-protonhoz. Ha csak donor-akceptor komplexrôl lett volna szó, akkor nagyon kicsi (1-2 Hz) lett volna az sp3 szénatomtól függô hosszú távú csatolás. Ezzel szemben a megjelent nagyon erôs (JH-H 10 Hz) csatolás azt mutatta, hogy a vizsgált mintában van olyan sp2-centrum, melyen keresztül hatásos lehet a hosszú távú H-H-csatolás. Az 1. ábrán látható a terc-butil, terc-amil és az izopropil-kation 1H-NMR-spektruma. Az eredetijük mementóként bekeretezve függ a dolgozószobámban hasonlóan a norbornil-kation ESCA-spektrumához.
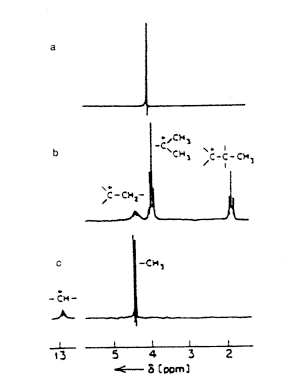
1. ábra. 1H-NMR-spektrumok:
a) terc-butil-kation [trimetil-karbénium-ion, (CH3)3C+];
b) terc-amil-kation [dimetil-etil-karbénium-ion, (CH3)2C+-C2H5];
c) izopropil-kation [dimetil-karbénium-ion, (CH3)2C+H]
60 MHz, 60 oC, SbF5:SO2ClF-oldatban.
A vizsgált ionokkal IR-spektroszkópiai méréseket is végeztünk (2. ábra). John Evans, aki abban az idôben a midlandi Dow-laboratórium spektroszkópusa volt, felajánlotta együttmûködését, és felvette, kiértékelte az alkilkationok vibrációs spektrumát. Nagy öröm számunkra, hogy 30 évvel késôbb Denis Sunko és munkatársai Zágrábban alacsony hômérsékleti mátrixleválasztási technikával felvett FT-IR spektruma (FT = Fourier-transzformáció), valamint Schleyer számításai jól egyeztek a mi korai eredményeinkkel, melyeket szobahômérsékleten, tiszta SbF5-ben kaptunk jóval az FT-IR-módszer bevezetése elôtt.
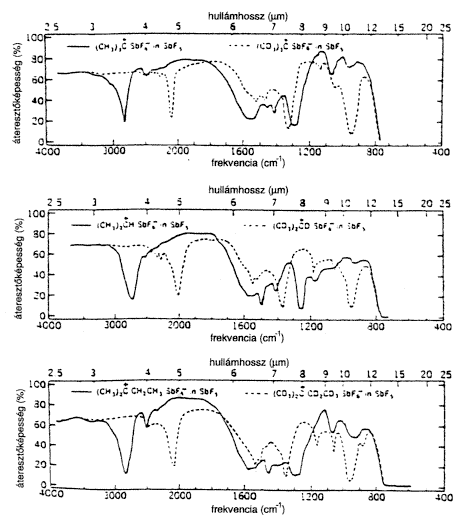
2. ábra. Terc-butil-, izopropil- és terc-amil-kation
IR-spektruma
Késõbb, 196870-ben Jack DeMemberrel és August Commeyrasszal együtt magunk is elvégeztük az alkilkationok IR- és lézeres Raman-spektroszkópiai vizsgálatát. Összehasonlítottuk a H-es és a deutériummal jelzett terc-butil-kationokra [6] és az izoelektronos trimetil-boránra [7] vonatkozó adatokat, és bebizonyosodott, hogy az elôbbi karbokation-centruma planáris (1. táblázat).
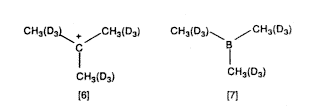
1. táblázat. Terc-butil- és [D9]-terc-butil-kation
IR- és Raman-frekvenciája
és korrelációjuk a (CH3)3B,
(CD3)3B változathoz
| vibrációs frekvencia (cm1) | ||||||||||||
| minta | n1,n12,
n7,n19 |
n2,n13 | n21 | n14 | n15 | n17 | n5 | n16 | n6 | n9 | n10 | n18 |
| (CH3)3C+ | 2947 | 2850 | 1450 | 1295 | 667 | 347 | 306 | |||||
| (CH3)3B | 2975 | 2875 | 1060 | 1440 | 1300 | 1150 | 906 | 866 | 675 | 973(486?) | 336a | 320 |
| (CD3)3C+ | 2187 | 2090 | 1075 | 980 | 720 | 347 | 300 | |||||
| (CD3)3B | 2230 | 2185 | 1033 | 1205 | 620 | 870 | (289)b | (276)b | ||||
a IR-frekvencia
b számított
Ez volt az elsô elképzelés arról, hogy csaknem minden karbokationnak megvan a semleges, izoelektromos, izostrukturális bóranalógja, amit késôbb R.E. Williams olyan pontosan be is bizonyított.
Elôször 1962 nyarán a brookhaveni Szerves Reakciómechanizmus Konferencián, majd késôbb számos más alkalommal módom volt nyilvánosan beszámolni kutatásainkról. Ekkor már hosszas, gyakran lehangoló próbálkozások után bizonyítani tudtam, hogy stabil, hosszú élettartamú alkilkationokat állítottunk elô szupersavas oldatokban.
Stabil, hosszú élettartamú karbokationok kémiája néven vált ismertté ez a tudományág és a kezdetek után egyre gyorsabban fejlôdik. Aki ipari laboratóriumban dolgozik, annak számára az eredmények publikációja nem mindig könnyû. Itt szeretnék ezért köszönetet mondani a Dow Chemical Company-nak, hogy nemcsak a munkát tették lehetôvé számomra, de azt is, hogy az eredményeket közöljem.
Azután, hogy elô tudtuk állítani a stabil, hosszú élettartamú karbokationokat antimon-pentafluorid-oldatban, elkezdtünk más szupersavakkal is dolgozni. Többféle ionizáló prekurzorban, beleértve az alkoholokat is, kísérleteztünk protikus savakkal, például FSO3H (fluor-kénsav), CF3SO3H (trifilsav, trifluor-metánszulfonsav), valamint konjugált savakkal, mint HF-SbF5, FSO3H-SbF5 (mágikus sav), CF3SO3H-SbF5, CF3SO3H-B(O3SCF3)3 stb. Sikeresek voltak a próbálkozások fluoridalapú szupersavakkal, mint AsF5, TaF5, NbF5. Az F5O3H-SbF5-nek a "mágikus sav" nevet egy német doktoranduszom adta, akivel a hatvanas években dolgoztam együtt Clevelandben. Ô egy laboratóriumi összejövetel után a karácsonyfa-gyertya maradékát ebbe a savba tette bele. A gyertya a savban tökéletesen feloldódott, és az oldatban ki tudtuk mutatni terc-butil-kation kiváló minôségû NMR-spektrumát. A jelenség élénk érdeklôdést váltott ki, ezért nevezte a savat "mágikusnak" és ez a név használatos lett a mi laborunkban. Azt hiszem, Ned Arnett volt az, aki az irodalomban is ezt használta, így ez egyre inkább ismertté vált. Késôbb egyik volt tanítványom, J. Svoboda egy kis céget alapított (Cationic néven), ahol ionos reagenseinket kereskedelmi forgalomba hozta, ô az elnevezést "Magic Acid®" formában védetté tette, ezzel a névvel került árusításra is.
| Vissza | http://www.kfki.hu/chemonet/
http://www.ch.bme.hu/chemonet/ |