A vegyületek konstitúciója és
metamorfózisa, valamint a szén kémiai természete
Részletek
Annalen der Chemie, 106: 129–159 (1858)
in: Henry Marshall Leicester and Herbert S. Klickstein, A Source
Book in Chemistry 1400-1900 (Harvard University Press,
Cambridge, Massachusetts, 1963)
A gyökök konstitúciója. A szén természete
Gyakorta hangoztatják, hogy a gyökök nem szorosan kapcsolódó atomok csoportjai, hanem csak egymáshoz közeli atomok együttesei, amelyek bizonyos reakciókban nem válnak szét, míg mások felbomlanak. Az egymás közelében elhelyezkedõ atomok és a reagáló anyag természetén múlik, hogy egy atomcsoport eljátssza-e az úgynevezett "gyök" szerepét. Általában azt mondhatjuk, hogy minél inkább különbözik az egyes atomok természete, annál könnyebben bomlik szét az atomcsoport, a gyök.
Ezeket a gondolatokat nem szükséges tovább fejtegetni:
egyetlen példával mutatom meg csupán, hogyan jöhet
létre az atomi csoportosulás. A kénsav gyöke, ![]() ,
három atomból áll, ezek mindegyike diatomos, tehát
két affinitásegységet képvisel.+Az
egyik atom egyik affinitásegysége a másik atom egyik
affintásegységével kapcsolódik össze.
A hat affinitásegység közül négy tartja
össze a három atomot, és kettõ megmarad, ezért
a csoport diatomos lesz, például egy monatomos elem két
atomjával egyesül:
,
három atomból áll, ezek mindegyike diatomos, tehát
két affinitásegységet képvisel.+Az
egyik atom egyik affinitásegysége a másik atom egyik
affintásegységével kapcsolódik össze.
A hat affinitásegység közül négy tartja
össze a három atomot, és kettõ megmarad, ezért
a csoport diatomos lesz, például egy monatomos elem két
atomjával egyesül:
| Szulfurilgyök | Szulfuril-klorid |
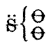 |
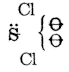 |
Ha a szulfuril-klorid reagál a vízzel, két HCl
hasad le, a maradék nem válik szét, és a keletkezõ
termék két olyan ![]() molekulának tekinthetõ, amelyben két H atomot
molekulának tekinthetõ, amelyben két H atomot ![]() csoport helyettesít.*
csoport helyettesít.*
Az atomok összekapcsolódásának módja hasonlóképpen mutatható meg az összes gyök esetében, beleértve a szenet tartalmazó gyököket is. Ehhez csupán a szén természetrérõl kell képet alkotnunk.
Ha csak a szén legegyszerûbb vegyületeit tekintjük (a mocsárgázt, a metil-kloridot, a szén-tetrakloridot, a kloroformot, a szénsavat, a foszgén gázt, a szén-diszulfidot, a cián-hidrogént stb.), feltûnõ, hogy az a szénmennyiség, amelyet a vegyész a lehetõ legkisebbként, atomként ismer, a monatomos elemeknek mindig négy atomjával, vagy a diatomos elemeknek mindig két atomjával egyesül; általában véve a szénatomhoz kapcsolódó elemek kémiai egységeinek összege 4. Ebbõl az következik, hogy a szén tetratomos (vagy négybázisú).**
Ennek megfelelõen a korábban említett három
elemcsoport mellett egyelõre a szén a tetratomos csoport
egyetlen képviselõje (a bór és a szilícium
vegyületei még kevéssé ismertek). A másik
három csoport elemeivel a következõképpen vegyül:
| IV + 4I | IV + (II+2I) | IV + 2II | IV + (III+I) | |
| vagy példákkal: | ||||
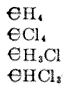 |
A több szénatomot tartalmazó vegyületek esetében fel kell tételezni, hogy legalább az atomok egy részét csak a szén affinitása tartja meg, és hogy maguk a szénatomok egymáshoz kapcsolódnak úgy, hogy az egyik szénatom másikkal szemben mutatott affinitásának egy része a másik affinitásának ugyanakkora részét köti meg.
Két szénatom legegyszerûbb és ezért legnyilvánvalóbb összekapcsolódásának esete az, amikor az egyik atom egyik affinitásegysége a másik atom egyik affinitásegységéhez kapcsolódik. A két szénatom 2 x 4 affinitásegysége közül tehát kettõ a két atomot tartja össze; a fennmaradó hat más elemek atomjait kötheti meg. Más szóval, a két szénatomból álló csoport hexatomos lesz, egy monatomos elem hat atomjával képez vegyületet, vagy általában annyi atommal, hogy a kémiai egységek összege hat legyen (például etil-hidrid, etil-klorid, 11/2 szén-tetraklorid, acetonitril, cián, aldehid, acetil-klorid, glikol stb.).
Ha több szénatomot teszünk össze hasonló módon, akkor minden újabb szénatom esetén két egységgel nõ a széncsoport bázicitása. Ezek szerint n darab, egymáshoz kapcsolt szénatomhoz
n(4–2) + 2 = 2n + 2
hidrogénatom (kémiai egység) kötõdik.
Tehát n = 5 esetén a bázicitás 12 (amil-hidrid, amil-klorid, amilén-klorid, valero-nitril, valeraldehid, valeril-oxid, angelikasav stb.). Mindeddig feltételeztük, hogy a szénatomhoz kapcsolódó összes atomot a szén affintása tartja meg. De ugyanúgy elképzelhetõ, hogy a poliatomos elemeknek (O, N stb.) csak az affinitásuk egy része, például az oxigén két egysége közül csak az egyik, vagy a nitrogén három egysége közül csak az egyik kötõdik a szénhez, és az oxigénnek egy, a nitrogénnek két affinitásegysége megmarad, és más elemekhez kötõdhet. Ezek az újabb elemek ily módon csak közvetve kapcsolódnak a szénhez, amit a következõ írásmóddal fejezhetünk ki:
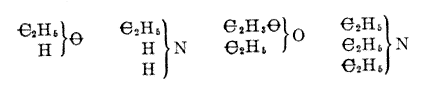
Amikor összehasonlítjuk azokat a vegyületeket, amelyek molekulájában azonos számú szénatom van, és amelyek egyszerû módon alakíthatók át egymássá (pl. alkohol, etil-klorid, aldehid, ecetsav, glikolsav, oxálsav stb.), arra a következtetésre jutunk, hogy a szénatomok ugyanúgy helyezkednek el, és csak azok az atomok változnak, amelyeket a szénváz köt meg.
Ha ezután a homológ testeket vesszük sorra, arra a következtetésre jutunk, hogy a szénatomok (függetlenül attól, hogy mennyi van egy molekulában), ugyanúgy, ugyanolyan szimmetriatörvényeknek engedelmeskedve rendezõdnek el bennük. Nagyfokú bomlás esetén, amikor a szénváz is részekre esik szét, az összes fragmentumban ugyanúgy rendezõdnek el a szénatomok, tehát a vegyület minden fragmentuma homológ a kiindulási anyaggal vagy azzal az anyaggal, amely egyszerû átalakítás révén nyerhetõ a homológ testbõl (pl. ha a hidrogént oxigén helyettesíti).
Számos szerves vegyületben feltételezhetõ a szénatomok eme "legegyszerûbb" elrendezése. Más vegyületek molekulái oly sok szénatomot tartalmaznak, hogy bennük sûrûbben kell elhelyezkedniük a szénatomoknak.***
A benzol és származékai, a benzollal homológ szénhidrogének, például olyan nagy széntartalmúak, hogy jellegzetesen különböznek az etil átalakításakor keletkezõ összes vegyülettõl.
A naftalin még több szenet tartalmaz. Fel kell tételeznünk, hogy ebben a vegyületben a szén elrendezése mág sûrûbb, tehát az egyes atomok még szorosabban kötõdnek egymáshoz.
Amikor ezeket a nagy széntartalmú szénhidrogéneket, a benzolt és homológjait, valamint a naftalint, összehasonlítjuk az alkoholcsoport szénhidrogénjeivel, amelyekkel sok tekintetben analógiát mutatnak, a következõt kapjuk:

Ha a második sor szénhidrogénjeit összehasonlítjuk az elsõ sor szénhidrogénjeivel, látjuk, hogy azonos hidrogéntartalom mellett több szenet tartalmaznak. Ugyanez áll az naftalinra és a toluolra is. Ezért úgy tûnik, mintha a szénatomok ugyanolyan fajta sûrûbb elrendezõdése ismétlõdne, mintha három széntartalmú vegyületcsoport lenne, amelyeket a szénatomok elrendezésének típusa különböztet meg egymástól.
+ Kekulétõl származik az "affinitásegységek" – mai szóval vegyértékkötések – fogalma. Õ ismerte fel, hogy a szén "tetratomos" elem. Ennek alapján tudta rendszerezni az alifás vegyületeket. Elméletének egyik fontos következménye volt, hogy a szénatomok összekapcsolódhatnak egymással.
* Könnyen belátható, hogy az ![]() csoportnak, amely bizonyos körülmények között
gyökként viselkedik, szintén diatomosnak kell lennie.
A kénnessav (mint hidrát) az egyik felfogás szerint
ugyanazt a gyököt tartalmazza, mint a kénsav, és
a
csoportnak, amely bizonyos körülmények között
gyökként viselkedik, szintén diatomosnak kell lennie.
A kénnessav (mint hidrát) az egyik felfogás szerint
ugyanazt a gyököt tartalmazza, mint a kénsav, és
a ![]() közbülsõ
típushoz tartozik, míg egy másik felfogás szerint
az
közbülsõ
típushoz tartozik, míg egy másik felfogás szerint
az ![]() gyök
egyik vegyülete, s a 2
gyök
egyik vegyülete, s a 2![]() típushoz tartozik. A két megfogalmazás egymás
szinonímája.
típushoz tartozik. A két megfogalmazás egymás
szinonímája.
** Ha a szenet tetratomos gyöknek tekintjük, néhány jól ismert vegyület igen egyszerû képlettel írható le. A további tárgyalás azonban túl messzire vezetne.
*** Könnyen meggyõzõdhetünk
arról, hogy ezeknek a vegyületeknek a képlete a szénatomok
"második legegyszerûbb" elrendezése alapján
konstruálható meg.
| Vissza | http://www.kfki.hu/chemonet/
http://www.ch.bme.hu/chemonet/ |