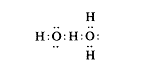
Polarizáció és ionizáció a Lewis-féle vegyérték-elmélet alapján
The Journal of the American Chemical Society 42, 1419–1433 (1920)
in: Henry Marshall Leicester: A Source Book in Chemistry 1900–1950
(Harvard University Press, Cambridge, Massachusetts, 1968)
Asszociált folyadékok
Már régen felismerték, hogy a folyadékok asszociációjának jelensége az oldószer dielektromos állandójával és ionizálóképességével van összefüggésben. Az egyik álláspont szerint az úgynevezett poláros oldószer jelentõs momentummal rendelkezõ dipólusokat tartalmaz, vagyis a pozitív és negatív töltések jelentõs távolságra válnak szét egymástól. Az ilyen folyadékok nagy dielektromos állandóját a dipólusok elektromos térben felvett orientációjának tulajdonítják. Két dipólus kölcsönös vonzása miatt is asszociációt tételeznek fel. Ezt a magyarázatot sok komoly kifogás illeti. Elõször is nehéz belátni, hogy a nagyon nagy dielektromos állandójú vegyületeknek miért kell fõként hidrogénvegyületeknek lenniük. A hidrogén-kloridnak nagyobb momentumú dipólusokat kell tartalmaznia, mint a víznek vagy a hidrogén-fluoridnak, de gõz- és folyadékállapotban is sokkal kisebb a dielektromos állandója. Sõt úgy látszik, hogy a hidrogén-klorid nem asszociált. Úgy tûnik tehát, hogy a magyarázatot máshol kell keresnünk.
Hasonlítsuk ismét össze az ammóniát, a vizet és a hidrogén-kloridot. Az ammónia könnyen felvesz egy hidrogént, de kis tendenciát mutat a leadásra. A hidrogén-klorid ugyanakkor elletétes tendenciát mutat. A víz középsõ helyet foglal el, és a hidrogén leadására és felvételére is mutat tendenciát, s e kettõ csaknem egyensúlyban van. A Lewis-féle elmélet alapján egy vízmolekula szabad elektronpárja elegendõ erõt fejthet ki egy hidrogénre, amelyet egy másik vízmolekula köt meg egy elektronpárral, hogy a két molekulát összekapcsolja. A szerkezetet így ábrázolhatjuk:
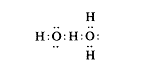
Ezeknek a kombinációknak nem kell kettõs vagy hármas molekulák képzõdésére korlátozódniuk. A folyadékban nagy molekula-aggregátumok is képzõdhetnek, amelyek folyamatosan szétszakadnak és újraképzõdnek a termikus keveredés hatására.
Ez a magyarázat azt jelenti, hogy a 2 oktettel megtartott hidrogén atommag gyenge "kötést" alkot.1 Az ammónium-hidroxid
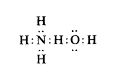
esetében az egyesülés elég erõs. Ez ellentmond annak az általánosan elfogadott nézetnek, mely szerint az ammónium-hidroxid gyenge bázikusságát az okozza, hogy az ammónium-hidroxid lényegében az ammónia vizes oldata. Az elmélet némiképp Lewis felfogásától is eltér az NH4+ polaritását illetõen. Úgy látszik azonban, nincs okunk feltenni, hogy az ammónium-kloridtól, ahol a hidrogén határozottan átkerül a klórról az ammóniára, nem lehet fokozatos változás a víz asszociációjáig, ahol a hidrogént még elég erõsen tartja az eredeti vízmolekula. Az ammónium-klorid valószínûleg majdnem olyan teljesen poláros a töltések szétválását tekintve, mint a nátrium-klorid, és közönséges hõmérsékleten a kristályt hasonló, alig kisebb erõk tartják össze. Ha azonban növeljük a hõmérsékletet, a kötés hidrogénje, amely nehéz részecske, nagyon gyorsan rezgési energiát vesz fel. Ez felszakítja a kristályszerkezetet, és az ammónium-klorid disszociációjához, olvadás nélküli párolgásához vezet. A hidrogén-klorid ilyen típusú vegyületet alkot a vízzel csakúgy, mint az ammóniával, de nyilvánvaló okok miatt ez kevésbé stabil, mint az ammónium-klorid.
Nem tételezzük fel, hogy minden asszociáció ilyen típusú. Az ecetsavban az asszociáció kétségtelenül 2 molekulából álló, meghatározott polimerek kialakulásával játszódik le. Ez a fajta asszociáció azonban olyan tulajdonságokat kelt, amelyek gyökeresen különböznek az olyan folyadékok tulajdonságaitól, mint a víz.
Ha a víz asszociációjáról alkotott képünk helyes, egy hidrogén atommagot két oxigén-oktett között olyan erõk tarthatnak meg, amelyek elég nagy távolságon engedelmeskednek a Hooke-törvénynek. Ez a hidrogén az elektromos tér hatására jelentõs mértékben eltolódhat. A dielektromos polarizáció matematikai elmélete pontosan ilyen mechanizmust rendel a nagy dielektromos állandó kialakulásához. A legnegatívabb elemek hidrogénvegyületei, például a hidrogén-fluorid esetében igen valószínû, hogy a nagyon koncentrált elektron-oktett elektromos vonzása és a hidrogén pozitív atommagjának egyidejû erõs taszítása miatt a molekulában a hidrogén rugalmasan kötött. Igen valószínû azonban, hogy a rendkívül nagy dielektromos állandót a molekulák asszociációja hozza létre.
-----------------
1. Kollégánk, Mr. Huggins egy még
publikálatlan munkájában a két atom között
megtartott hidrogén-kernel fogalmát
bizonyos szerves vegyületek értelmezésére használta.
| Kémiatörténet | http://www.kfki.hu/chemonet/
http://www.chemonet.hu/ |