Hermann von Helmholtz
(1821–1894)
Faraday elektromosság-fogalmának fejlôdése
napjainkban [1881]
Faraday elôadás Londonban, 1881. április
5-én
(A ChemTeam
gyûjteményében megjelent szöveg alapján)
Elôzô rész
Meg kell jegyeznem, hogy eddig csak jelenségekrôl beszéltünk.
Az elektromosság mozgása nyomon követhetô és
mérhetô. A kémiai komponensek mozgása ettôl
függetlenül szintén mérhetô. A kémiai
elemek ekvivalensei és az elektromosság ekvivalens mennyiségei
olyan számok, amelyek valódi összefüggéseket
fejeznek ki a természeti objektumok és hatások között.
Lehet ugyan, hogy a kémiai elemek ekvivalens relációi
csak hipotetikusan következnek az atomok létének feltevésévôl,
de eddig nincs más, kellôképpen kidolgozott elméletünk,
amely a kémia összes jelenségét olyan egyszerû
és konzisztens módon magyarazná, mint a modern kémia
atomelmélete.
A Faraday-törvénynek talán éppen ez a legmeglepôbb
eredménye. Ha elfogadjuk azt a hipotézist, hogy az elemi
anyagok atomokból állnak, akkor nem kerülhetjük
el azt a következtetést, hogy mind a pozitív, mind a
negatív elektromosság meghatározott elemi részekre
osztható, amelyek az elektromosság atomjaiként viselkednek.
Amíg az egyes ionok az elektrolitban mozognak, nem válnak
szét elektromos ekvivalensüktôl vagy ekvivalenseiktôl.
Az elektródok felületén akkor játszódhat
le bomlás, ha az elektromotoros erô elegendô; ekkor
az ionok leadják elektromos töltésüket és
elektromosan semlegessé válnak.
Ugyanannak az atomnak a töltése különbözô
vegyületekben a pozitív vagy a negatív elektromosság
ekvivalenseitôl is származhat.. Faraday rámutatott
arra, hogy a kén mint elem kationként vagy anionként
is viselkedhet. Az ezüst-szulfidban anion, az erôs kénsavban
talán kation. Ezután Faraday feltette, hogy a kén
a kénsavból másodlagos eredményként
csapódik ki. A kation a hidrogén lehet, amely a sav oxigénjével
reagálva kilöki a ként. De ha így van, az oxigénnel
vízzé egyesülô hidrogénnek meg kell tartania
pozitív töltését, és ekkor a kénnek
kell leadnia pozitív ekvivalenseket a katódnak. Ezért
a kénsav kénjét az elektromosság pozitív
ekvivalenseinek kell töltéssel ellátnia.
Amikor a pozitív töltésû hidrogénatomok
vagy más kationok kiválnak az elektrolitból és
gázzá alakulnak át, a gáz elektromosan semleges
lesz: dualista szóhasználattal élve azonos mennyiségû
pozitív és negatív elektromosságot tartalmaz.
Elképzelhetô, hogy minden egyes atom elektromosan semlegesítôdik,
vagy egy pozitív töltésûnek megmaradt atom egyesül
egy másik, negatív töltésûvel. Ez utóbbi
feltevés egyezik az Avogadro-törvény következményével,
amely szerint a szabad hidrogén molekulája valójában
két atomból áll.
Felmerül a kérdés, hogy az elektromosság és
a kémiai vegyülés között fennálló
összefüggések csak azokra az anyagokra vonatkoznak-e,
amelyeket elektrolitoknak nevezünk? Ha olyan erôsségû
áramot kívánunk elôállítani, amellyel
elegendô bomlásterméket gyûjthetünk össze
anélkül, hogy túlságosan sok hô fejlôdne
az elektrolitban, az elbontandó anyagnak nem szabad túlságosan
nagy ellenállást tanúsítania az árammal
szemben. Ez az ellenállás azonban igen nagy, az ionok mozgása
pedig igen lassú lehet – olyan lassú, hogy akár több
száz évig is fenn kellene tartanunk, hogy csak nyomnyi bomlástermékhez
jussunk. Az elektrolitikus folyamat minden fontos jellemzôje közben
mégis fennmaradhat. A különbözô folyadékok
igen különbözô mértékû vezetôképességet
mutathatnak. Számos esetben – egészen a desztillált
vízig és a tiszta alkoholig – az áram áthaladását
érzékeny galvanométerrel követhetjük nyomon.
De ha terpentinolajat, benzolt és más hasonló anyagokat
vizsgálunk, a galvanométer mutatója mozdulatlan marad.
Pedig ezek a folyadékok is rendelkeznek némi vezetôképességgel.
Ha az elektromosan töltött vezetôt egy terpentinolajjal
töltött cella egyik elektródjához és a földhöz
csatlakoztatjuk, a vezetô elektromos töltése eltéveszthetetlenül
gyorsabban sül ki a terpentinolajon keresztül, mintha a cellát
csak levegôvel töltenénk meg.
Ebben az esetben is megfigyelhetjük az elektródok polarizációját,
amely a korábban lejátszódott elektrolízisre
utal. Kössük a terpentinolajba merülô két platinadarabot
nyolc Daniell-cellából összeállított elemhez,
hagyjuk huszonnégy órán át állni, ezután
vegyük el az elemet, és kössük az elektródokat
egy kvadráns elektrométerhez. A mûszer azt jelzi, hogy
a két platinafelület, amely korábban homogén
volt, elektromotoros erôt hoz létre, amely az elektrométer
tûjét eltéríti. Ennek a polarizációnak
az elektromotoros erejét néhány esetben meghatározta
Picker úr a Berlini Egyetem laboratóriumában, és
azt tapasztalta, hogy az alkohol polarizációja csökken
az alkohol víztartalmának növekedésével.
...
Az elektrolitikus vezetés másik jele, hogy a különbözô
fémek közé helyezett folyadékok elektromotoros
erôt hoznak létre. Ez soha nem játszódik le
azonos hômérsékletû fémek vagy más
vezetôk hatására, amelyek a fémekhez hasonlóan
anélkül engedik át az elektromos áramot, hogy
elbomlanának. Elektromotoros erô fellépése figyelhetô
meg sok merev test esetében is, bár nagyon kevesnél
mutatható ki az elektrolitikus vezetés galvanométerrel,
és ez is csak akkor, ha a hômérséklet megközelíti
az anyagok olvadáspontját. Emlékeztetni szeretném
Önöket Zamboni galvánoszlopára, amelyben száraz
papírdarabok választják el a vékony fémlapokat.
Ha a kapcsolat elég sokáig fennmarad, még az üveg,
a gyanta, a sellak, a paraffin, a kén – az általunk ismert
legjobb szigetelôk – is ugyanígy viselkednek. Szinte lehetetlen
megakadályozni, hogy az érzékeny elektrométer
kvadránsait fel ne töltsék a szigetelô anyagok,
amelyeken támaszkodnak.
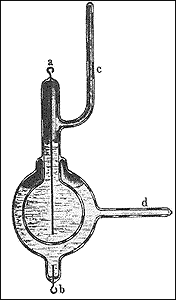 Valaki felvethetné,
hogy a felsorolt esetekben az a kevés nedvesség, amelyet
az anyag felvett vagy a felületre tapadt, elektrolit volt. Ezért
mutatom meg most Önöknek ezt a kis Daniell-cellát, amelyet
egy korábbi asszisztensem, Dr. Giese készített. A
hermetikusan lezárt üveggömbben réz-szulfát
oldat van; az a elektród platinahuzal. A gömböt
egy üreg veszi körül; ebbe cink-szulfát és
egy kevés cinkamalgám van bezárva, amelybe egy másik
platinahuzal, b nyúlik be az üvegen keresztül.
A c és d csô szolgált a folyadékok
bevezetésére. Az edény feltöltése után
a csöveket lezárták. A készülék Daniell-cellára
emlékeztet, amelynek porózus válaszfalát vékony
üvegréteg helyettesíti. Kívülrôl minden
szimmetrikus a két pólusnál; semmi sem érintkezik
a levegôvel, csak az üveg zárt felületével,
amelyen a platinahuzalok áthatolnak. Az elektrométer így
olyan, mint egy nagyon nagy ellenállású Daniell-cella.
Nem ez lenne a helyzet, ha az üveg válaszfal nem viselkedne
elektrolitként, hiszen a fémes vezetô polarizációja
révén azonnal hatástalanítaná a cella
mûködését.
Valaki felvethetné,
hogy a felsorolt esetekben az a kevés nedvesség, amelyet
az anyag felvett vagy a felületre tapadt, elektrolit volt. Ezért
mutatom meg most Önöknek ezt a kis Daniell-cellát, amelyet
egy korábbi asszisztensem, Dr. Giese készített. A
hermetikusan lezárt üveggömbben réz-szulfát
oldat van; az a elektród platinahuzal. A gömböt
egy üreg veszi körül; ebbe cink-szulfát és
egy kevés cinkamalgám van bezárva, amelybe egy másik
platinahuzal, b nyúlik be az üvegen keresztül.
A c és d csô szolgált a folyadékok
bevezetésére. Az edény feltöltése után
a csöveket lezárták. A készülék Daniell-cellára
emlékeztet, amelynek porózus válaszfalát vékony
üvegréteg helyettesíti. Kívülrôl minden
szimmetrikus a két pólusnál; semmi sem érintkezik
a levegôvel, csak az üveg zárt felületével,
amelyen a platinahuzalok áthatolnak. Az elektrométer így
olyan, mint egy nagyon nagy ellenállású Daniell-cella.
Nem ez lenne a helyzet, ha az üveg válaszfal nem viselkedne
elektrolitként, hiszen a fémes vezetô polarizációja
révén azonnal hatástalanítaná a cella
mûködését.
Mindezek a példák azt mutatják, hogy az elektrolitikus
jelenség nem korlátozódik a savak és sók
oldataira. Nagyon nehéz lenne azonban megállapítani,
hogy milyen mértékben terjed ki az elektrolitikus vezetés.
Erre a kérdésre ma még nem tudok határozott
választ adni. Mindössze arra szerettem volna Önöket
emlékeztetni, hogy az elektromos mozgásokkal kiváltott
bomlási képesség nem szükségképpen
kötôdik kis ellenálláshoz, s az elektromos és
kémiai erô kapcsolata nem korlátozódik az általában
használt savas és sós oldatokra.
Eddig a ponderábilis anyag, valamint az elektromosság
elektrolitban zajló mozgásait tanulmányoztuk. Vizsgáljuk
most meg azokat az erôket, amelyel ezeket a mozgásokat kiválthatják.
Mindazok, aki tudják, milyen nagyok a kémiai erôk,
milyen hatalmas hô és mechanikai munka termelésére
képesek, mindig is meglepôdtek, hogy milyen csekély
az elektromos vonzás a két Daniell-cellából
álló elem pólusainál, noha az elem képes
a vízbontásra. Egy gramm víz, amely hidrogén
és oxigén elégeteskor keletkezik, annyi hôt
fejleszt, hogy ha ezt a hôt egy gôzgép mechanikai munkává
alakítja át, ugyanezt a súlyt 1600000 méter
magasra tudná emelni. Ugyanakkor a legérzékenyebb
eszközökkel tudjuk csak kimutatni, hogy a selyemszálon
függô aranyfólia vagy kis alumíniumdarabka egyáltalán
elmozdul-e az elem elektromos vonzásának hatására.
A rejtélyt akkor fejthetjük meg, ha megvizsgáljuk azokat
az elektromos mennyiségeket, amelyek az atomok töltéseiként
jelennek meg.
Az az elektromos mennyiség, amelyet egy nagyon kis mennyiségû
hidrogén szállít, az elektrosztatikus erô mérésébôl
roppant nagynak adódik. Faraday tudta ezt, és különféle
próbákat tett, hogy legalább közelítô
értéket kapjon. Megállapította, hogy még
a voltaméteren keresztül kisütött legerôsebb
leideni palackok is alig szolgáltatnak
észlelhetô mennyiségû gázt. Ma már
pontos adataink is vannak. A galvános áram elektromágneses
egységének elektrokémiai egyenértékét
Bunsen és újabban más fizikusok is meghatározták.
Ezt a meghatározást az elektromosság elektromágneses
és elektrosztatikus hatásainak igen bonyolult összevetése
követte, amelyet elôször Weber professzor, majd a British
Association támogatásával Clerk Maxwell professzor
végzett el. Az eredmény szerint egy milligramm víz,
amelyet két, egymástól egy kilométerre levô,
egymással összekötött gömbbe osztanak szét,
akkora elektromossággal rendelkezik, amennyi 26800 kilogramm súlyával
azonos vonzást hozna létre. (Az egy milligramm vízben
tárolt elektromosság mennyisége kétszer ekkora
lenne, két milligramm víz négyszer ennyire vonzaná
egymást, vagyis 102180 kilogramm súlyával. [1884-es
kiegészítés a német fordításban])
Amint már megjegyeztem, az a törvény, hogy az erô
intenzitása fordítottan arányos a távolság
négyzetével, és arányos a vonzó és
a vonzott tömegek mennyiségével, akkor is érvényes,
ha a gravitáció olyan hidrogén- és oxigéntömeg
között hat, amelyek elektromos töltései is vonzzák
egymást. Az eredmény ezeknek a tömegeknek a méretétôl
és távolságától függetlenül
is fennáll. Azt találjuk, hogy az elektromos erô nagyobb,
mint a ponderábilis tömegek gravitációja: 71000
milliárdszor nagyobb, mint az oxigéné és a
hidrogéné, amely ezeket az elektromos töltéseket
hordozza.
Az a teljes erô, amelyet egy elektromosan töltött test
egy másik, ellentétes töltésû testre vonzás
közben kifejt, mindig arányos azzal az elektromos mennyiséggel,
amelyet a vonzó és a vonzott test hordoz. Így bár
egy kis elem pólusai által kifejtett vonzóerôk
olyan töltés mellett is képesek vízbontásra,
amelyet elektromos berendezéseinkben keltve igen mérsékeltnek
tartunk, ugyanez a kis elem az egy milligramm vízben levô
atomok óriási töltéséire akkora erôt
fejt ki, amely a legerôsebb kémiai affinitással is
összemérhetô.
Ha most megvizsgáljuk, hogy a ponderábilis molekulák
mozgásai hogyan függenek ezeknek az erôknek a hatásától,
kétféle esetet kell megkülönböztetnünk.
Elôször is megkérdezhetjük: milyen erôk szükségesek
ahhoz, hogy az ionok elôre mozduljanak el töltésükkel
együtt a folyadék belsejében? Másodszor: mi szükséges
ahhoz, hogy az ion kiváljon az oldatból és korábbi
vegyületébôl?
Kezdjük azzal az esettel, amikor a vezetô folyadékot
mindenütt szigetelôk veszik körül. Ekkor a felületén
semmilyen elektromosság nem léphet ki és nem távozhat,
de a pozitív elektromosság az egyik, a negatív a másik
oldalra vándorolhat a külsô, elektromosan töltött
testek vonzó és taszító erôinek a hatására.
Ezt a folyamatot, amely minden fémes vezetôben is lejátszódik,
elektrosztatikus indukciónak nevezik. A folyékony vezetôk
ilyen körülmények között ugyanúgy viselkednek,
mint a fémek. Ha a két test felületének nagy
részei egymáshoz igen közel kerülnek, jelentôs
mennyiségû elektromosság gyülemlik fel. Ezt az
elrendezést elektromos kondenzátornak nevezik. Olyan elektromos
kondenzátorokat készíthetünk – Ayrton és
Perry urak újabb kíséreleti nyomán –, amelyek
egyik felülelete folyadékfelület. Sir W. Thomson vízcseppes
berendezése, amely nagy elektromosságot gyûjt össze,
ezeknek a kondenzátoroknak különleges formája:
tökéletes szabályossággal tölthetô
fel azzal a legkisebb elektromotoros erôvel is, amelyet a legérzékenyebb
elektrométerek észlelni képesek. Wullner professzor
bebizonyította, hogy ha legjobb szigetelôinket hosszú
ideig elektromos hatásnak tesszük ki, végül ugyanolyan
módon töltôdnek fel, ahogy a fémek egy szempillantás
alatt. Nem lehet kétséges, hogy még az 1/100 Daniellnél
kisebb elektromotoros erôk is tökéletes elektromos egyensúlyt
hoznak létre az elektrolit folyadék belsejében.
Ugyannek a hatásnak egy másik, kissé módosított
példája figyelhetô meg abban a voltametrikus cellában,
amelynek két platinaelektródját Daniell-cellához
kötik, de a cella elektromotoros ereje nem elegendô az elektrolit
elbontására. Ekkor az elektródokhoz szállított
ionok nem tudják leadni elektromos töltésüket.
Az egész berendezés úgy viselkedik – ahogy Sir W.
Thomson elôször felhívta rá a figyelmet –, mint
egy óriási kapacitású kondenzátor. A
kondenzátorban felgyülemlô elektromosság – azonos
elektromotoros erô mellett – fordítva arányos a lemezek
távolságával. Ha ez az egyszázadára
csökken, a kondenzátor százszor több elektromosságot
vesz föl, mint korábban. Ha most a két platinafelületet
és a folyadékot egymáshoz érintjük, távolságukat
molekuláris méretûre csökkentjük. Ilyen kondenzátor
kapacitását határozták meg Varley, Kohlrausch
és Colley urak. Magam is végeztem néhány kísérletet,
amelyek azt mutatták, hogy a folyadékban elnyelôdött
oxigén jelentôsen befolyásolja az értéket.
A gázok teljes kiûzése után kisebb értéket
kaptam, mint Kohlrausch, ami arra utal, hogy ha a két azonos platinalemez
közötti teljes polarizációt egyenlôen felosztjuk,
a pozitív és negatív elektromosság két
rétege közötti távolságnak a milliméter
1/10 000 000 (Kohlrausch szerint 1/15 000 000) részének
kell lennie (a két réteg közül az egyik a fém,
a másik a folyadék legkülsô molekuláira
kerül). Csaknem ez a határérték adódik,
amikor kiszámoljuk a molekuláris erôk hatótávolságát,
amint azt Sir. W. Thomson több más példában is
kimutatta.
Ennek az elektrolitos galvanométernek olyan óriási
a kapacitása, hogy ha csak a legkisebb elektromoros erôvel
van is feltöltve, a galvanométer könnyen jelzi a belépô
elektromos mennyiséget. Amit most a kondenzátor feltöltésének
nevezek, korábban a fémlemez polarizációjának
hívtam. Valójában mindkettô ugyanaz a folyamat,
hiszen az elektromos mozgást mindig kémiai bomlás
kíséri az elektrolit oldatokban.
Ha az elsô ábrán
bemutatott cellához hasonló cellában figyeljük
meg a polarizáló és depolarizáló áramokat,
akár az igen kicsiny, 1/1000 Daniell-cellányi elektromtoros
erô is elegendô a jelenségek vizsgálatához.
Azt tapasztaltam, hogy eddig a határig a kondenzátorba belépô
elektromosság mennyisége arányos volt az elektromosságot
összegyûjtô elektromotoros erôvel. Úgy gondolom,
hogy nagyobb platinafelületekkel még kisebb határértéket
érhetünk el.
Ha az elektromos töltések közötti erôn kívül
bármilyen más kémiai erô is létezne,
amely az összes ellentétes töltésû iont összekötné
és bármekorra munkát igényelne is ennek az
erônek a legyôzése, az olyan elektromotoros erôknek,
amelyek képesek az ionokat az elektródokhoz vonzani és
ezeket kondenzátorokként feltölteni, alsó határértékkel
kellene rendelkezniük. Eddigi tudásunk szerint semmilyen jelenség
nem utal ilyen határértékre, ezért azt a következetetést
kell levonnunk, hogy semmilyen más erô nem tartóztatja
fel az ionok mozgását a folyadékok belsejében,
mint az elektromos töltések kölcsönös vonzása.
A vonzóerô megakadályozza, hogy az egymást taszító,
azonos töltésû atomok egy helyen gyûljenek össze,
és a másik típusú atomok, amelyeket az elôbbiek
vonzanak, a folyadék bármely más helyén gyûljenek
fel, amíg a külsô elektromos erô kedvez ennek az
eloszlásnak. Az elektromos vonzás ily módon oda vezethet,
hogy az ellenkezô töltésû atomok egyenletes eloszlást
vesznek fel az egész folyadékban, és így a
folyadék minden alkotórésze elektromosan is, kémiailag
is semlegessé válik.
Másrészt, amint az ion megválik elektromos töltésétôl,
azt tapasztaljuk, hogy az elem elektromos erôi jelentôs ellenállással
találkoznak, amelynek a legyôzése nagy munkát
igényel. Az ionok elektromos töltésük elvesztésével
egy idôben rendszerint ki is válnak az oldatból; némelyek
gázzá alakulnak át, mások merev rétegként
tapadnak az elektródok felüeltére, mint az elektrolízissel
leválasztott réz. De azoknak az alkotórészeknek
az egyesülése, amelyeknek elegendô affinitásuk
van ahhoz, hogy vegyületet alkossanak – amint Önök mindannyian
nagyon jól tudják –, nagy mennyiségû hôt
termel, és a hô munkával egyenértékû.
Ennek megfelelôen a vegyületek bomlása munkát
igényel, mert a vegyületek energiát tárolnak.
Hiszen amikor a hidrogén az oxigénben elég, az oxigénnel
vízzé egyesül, és jelentôs mennyiségû
hôt fejleszt. A vízben a két elem közötti
kémiai vonzás továbbra is olyan hatást fejt
ki, mint korábban, hogy az elemeket erôsen összetartsa,
de már semmilyen változást nem tud létrehozni.
Az összekapcsolódott elemeket elôzô állapotukba
kell visszavinnünk – akkora erôvel kell szétválasztanunk
ôket, amkkora legyôzi az affinitásukat –, hogy elôzô
reakciókészségük újra megjelenhessen.
A kémiai egyesüléskor keletkezô hô mennyisége
azonos azzal a munkával, amely a vegyület szétválasztásához,
valamint a szabad hidrogén és oxigén visszaállításához
szükséges. Ezt az értéket a gravitációs
erô ellenében felemelt súly példájával
számítottam ki korábban.
Az oxigénnel vagy a halogénekkel egyesülô fémek
hasonló módon termelnek hôt; néhányuk,
például a kálium, a nátrium és a cink
még több hôt termel, mint az azonos mennyiségû
hidrogén. A kevésbé oxidálható fémek,
például a réz, az ezüst és a platina kevesebb
hôt fejleszt. Ezért hôképzôdést
tapasztalunk, amikor a cink kiszorítja a rezet a kénsav halogénjével
képzett vegyületbôl, ami a Daniell-cella esetében
is lejátszódik.
Ha bármely vezetôn – fémhuzalon vagy elektrolit
folyadékon – galvános áram halad át, hô
fejlôdik. Dr. Joule bizonyította be elôször kísérletileg,
hogy ha az áramkör nem végez más munkát,
a galvanikus áramkörben adott idô alatt fejlôdô
összes hô pontosan egyenlô azzal a hôvel, amelyet
ugyenez alatt az idô alatt kellett volna a kémiai reakcióknak
termelniük. De ez a hô nem azoknak az elektródoknak a
felületén fejlôdik, ahol ezek a kémiai reakciók
lejátszódnak, hanem az áramkör minden részében,
és arányos az egyes részek galvános ellenállásával.
Ebbôl nyilvánvaló, hogy a fejlôdô hô
nem a kémiai reakció, hanem a galvános áram
azonnali hatása és az elem kémiai munkája csak
elektromos hatások kiváltására fordítódik.
 Valaki felvethetné,
hogy a felsorolt esetekben az a kevés nedvesség, amelyet
az anyag felvett vagy a felületre tapadt, elektrolit volt. Ezért
mutatom meg most Önöknek ezt a kis Daniell-cellát, amelyet
egy korábbi asszisztensem, Dr. Giese készített. A
hermetikusan lezárt üveggömbben réz-szulfát
oldat van; az a elektród platinahuzal. A gömböt
egy üreg veszi körül; ebbe cink-szulfát és
egy kevés cinkamalgám van bezárva, amelybe egy másik
platinahuzal, b nyúlik be az üvegen keresztül.
A c és d csô szolgált a folyadékok
bevezetésére. Az edény feltöltése után
a csöveket lezárták. A készülék Daniell-cellára
emlékeztet, amelynek porózus válaszfalát vékony
üvegréteg helyettesíti. Kívülrôl minden
szimmetrikus a két pólusnál; semmi sem érintkezik
a levegôvel, csak az üveg zárt felületével,
amelyen a platinahuzalok áthatolnak. Az elektrométer így
olyan, mint egy nagyon nagy ellenállású Daniell-cella.
Nem ez lenne a helyzet, ha az üveg válaszfal nem viselkedne
elektrolitként, hiszen a fémes vezetô polarizációja
révén azonnal hatástalanítaná a cella
mûködését.
Valaki felvethetné,
hogy a felsorolt esetekben az a kevés nedvesség, amelyet
az anyag felvett vagy a felületre tapadt, elektrolit volt. Ezért
mutatom meg most Önöknek ezt a kis Daniell-cellát, amelyet
egy korábbi asszisztensem, Dr. Giese készített. A
hermetikusan lezárt üveggömbben réz-szulfát
oldat van; az a elektród platinahuzal. A gömböt
egy üreg veszi körül; ebbe cink-szulfát és
egy kevés cinkamalgám van bezárva, amelybe egy másik
platinahuzal, b nyúlik be az üvegen keresztül.
A c és d csô szolgált a folyadékok
bevezetésére. Az edény feltöltése után
a csöveket lezárták. A készülék Daniell-cellára
emlékeztet, amelynek porózus válaszfalát vékony
üvegréteg helyettesíti. Kívülrôl minden
szimmetrikus a két pólusnál; semmi sem érintkezik
a levegôvel, csak az üveg zárt felületével,
amelyen a platinahuzalok áthatolnak. Az elektrométer így
olyan, mint egy nagyon nagy ellenállású Daniell-cella.
Nem ez lenne a helyzet, ha az üveg válaszfal nem viselkedne
elektrolitként, hiszen a fémes vezetô polarizációja
révén azonnal hatástalanítaná a cella
mûködését.