
Niels Bohr
(1885-1962)
Niels Bohr és D. Coster
A Röntgen-spektrumok és az elemek periódusos rendszere
részletek
(Roentgen Spectra and the Periodic System of the Elements)
(Zeistschrift für Physik, Vol. 12 (1923), pp. 342-349)
(Eduard Farber: Milestones of Modern Chemistry, Basic Books, Inc., Publishers, New York, London, 1966)
 |
|
Niels Bohr |
A folyóirat egyik korábbi cikkében [1] a szerzôk egyike egy atomszerkezet-elmélet fô aspektusait fejtette ki. Ennek az elméletnek az alapján lehetségesnek látszik az optikai és a Röntgen-spektrumok olyan értelmezése, amely közeli kapcsolatban áll az elemek periódusos rendszerének értelmezésével. A dolgozat megjelenése után az elmélet ellenôrzésére alkalmas, kísérleti Röntgen-spektrometriás anyag jelentôsen gazdagodott a másik szerzô vizsgálatai nyomán. A mérési adatok és az elmélet kapcsolatát egy nemrégiben publikált cikk tárgyalta [2], amely számos érdekes eredményre derített fényt. A mostani közös dolgozatban a kísérleti adatok és az elmélet összevetése valamelyest mélyrehatóbb, mint az idézett tanulmányokban, és elôtérbe kerül a Röntgen-spektrumok alkalmazása a periódusos rendszer értelmezésére.
Az atomszerkezet elméletérôl
Az elmélet az atomban lévô elektronpályák osztályozására épül, amely a centrális mozgást végzô elektron stacionárius állapotainak összehasonlításán alapul. A pályákat nk jelöli. n az úgynevezett "fôkvantumszám", amely határesetben, amikor a centrális mozgás egyszerû, periodikus Kepler-mozgás [3], az egyetlen energiameghatározó tényezô, amint a hidrogén-spektrumra vonatkozó Balmer-formulából kitûnik. Szintén jól ismert, hogy az elektron pályájának középpontjára vonatkoztatott impulzusmomentumát az "azimutális kvantumszám", k jelöli, amely attól függôen játszik szerepet az energiában, hogy a mozgás mennyire tér el az egyszerû periodikus mozgástól. Ennek a kvantumszámnak a bevezetésén alapul természetesen a hidrogénvonalak finomszerkezetére vonatkozó Sommerfeld-elmélet. A finomszerkezet azért lép fel, mert a mechanika törvényeinek relativisztikus módosulása következtében még a pozitív atommag körül keringô egyetlen elektron pályája sem szigorúan periodikus, hanem olyan Kepler-ellipszissel írható le, amely a pálya síkjában lassú forgást végez. Azoknak az elektronoknak a száma, amelyek - az elmélet szerint - a normális [nem gerjesztett] atom különbözô típusú nk-pályáihoz tartoznak, az 1. táblázatban szerepel. Az itt leírt atomszerkezet - a jellegzetes új vonásoktól eltekintve - sok hasonlóságot mutat azokkal elméletekkel, amelyeken Sommerfeld és Vegard Röntgen-spektrum vizsgálatai alapulnak.
1. táblázat
| Elem / nk | 11 | 21 | 22 | 31 | 32 | 33 | 41 | 42 | 43 | 44 | 51 | 52 | 53 | 54 | 61 | 62 | 63 | 64 | 65 | 66 | 71 | 72 |
| 1 H 2He |
1 2 |
|||||||||||||||||||||
| 3 Li 4 Be 5 B 10 Ne |
2 2 2 2 |
1 2 2 4 |
(1) 4 |
|||||||||||||||||||
| 11 Na 12 Mg 13 Al 18 A |
2 2 2 2 |
4 4 4 4 |
4 4 4 4 |
1 2 2 4 |
1 4 |
|||||||||||||||||
| 19 K 20 Ca 21 Sc 22 Ti 29 Cu 30 Zn 31 Ga 36 Kr |
2 2 2 2 2 2 2 2 |
4 4 4 4 4 4 4 4 |
4 4 4 4 4 4 4 4 |
4 4 4 4 6 6 6 6 |
4 4 4 4 6 6 6 6 |
1 2 6 6 6 6 |
1 2 (2) (2) 1 2 2 4 |
1 4 |
||||||||||||||
| 37 Rb 38 Sr 39 Y 40 Zr 47 Ag 48 Cd 49 In 54 X |
2 2 2 2 2 2 2 2 |
4 4 4 4 4 4 4 4 |
4 4 4 4 4 4 4 4 |
6 6 6 6 6 6 6 6 |
6 6 6 6 6 6 6 6 |
6 6 6 6 6 6 6 6 |
4 4 4 4 6 6 6 6 |
4 4 4 4 6 6 6 6 |
1 2 6 6 6 6 |
1 2 (2) (2) 1 2 2 4 |
1 4 |
|||||||||||
| 55 Cs 56 Ba 57 La 58 Ce 59 Pr 71 Lu 72 -- 79 Au 80 Hg 81 Tl 86 Nt |
2 2 2 2 2 2 2 2 2 2 2 |
4 4 4 4 4 4 4 4 4 4 4 |
4 4 4 4 4 4 4 4 4 4 4 |
6 6 6 6 6 6 6 6 6 6 6 |
6 6 6 6 6 6 6 6 6 6 6 |
6 6 6 6 6 6 6 6 6 6 6 |
6 6 6 6 6 8 8 8 8 8 8 |
6 6 6 6 6 8 8 8 8 8 8 |
6 6 6 6 6 8 8 8 8 8 8 |
2 8 8 8 8 8 8 |
4 4 4 4 4 4 4 6 6 6 6 |
4 4 4 4 4 4 4 6 6 6 6 |
1 1 1 1 2 6 6 6 6 |
1 2 (2) (2) (2) (2) (2) 1 2 2 4 |
1 4 |
|||||||
| 87 -- 88 Ra 89 Ac 90 Th 118 Y |
2 2 2 2 2 |
4 4 4 4 4 |
4 4 4 4 4 |
6 6 6 6 6 |
6 6 6 6 6 |
6 6 6 6 6 |
8 8 8 8 8 |
8 8 8 8 8 |
8 8 8 8 8 |
8 8 8 8 8 |
6 6 6 6 8 |
6 6 6 6 8 |
6 6 6 6 8 |
8 |
4 4 4 4 6 |
4 4 4 4 6 |
1 2 6 |
1 2 (2) (2) 4 |
4 |
Megjegyzés: 1925-re a Röntgen-spektrumok alapján megváltoztatták az alcsoportok egyenletes elektroneloszlást; az új szabály 4 elektronos, lépésenkénti növekedést írt elô. Így a 86-os elemet, amelyet ma Rn-nel jelölnek (az Nt=niton helyett), a következô elektron-konfugráció reprezentálta (E. Farber):
2 | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 10 | 2 6
A táblázatból kitûnik, hogy elektronpályák olyan csoportokat alkotnak, amelyek ugyanahhoz az n fôkvantumszámhoz tartoznak. Ezeknek a csoportoknak a kialakulása - a nagyobb atomszámú [rendszámú] elemek felé haladva - kapcsolatban áll a periódusos rendszerben jelentkezô szabályszerûségekkel. Igen fontos tulajdonság, hogy a csoportok alcsoportokra bomlanak, amelyek a k azimutális kvantumszám különbözô értékeinek felelnek meg. Az elemek rendszerének egyszerû periodicitásától való tipikus eltérések oka (a vascsoport, a platinafémek és a ritkaföldfémek esetében) az lehet, hogy
Ezeket a jellegzetességeket különösen jól szemlélteti a periódusos rendszer 1. ábra szerinti elrendezése, ahol a rendszer azonos periódusához tartozó elemek függôleges oszlopokba kerültek. Az egymást követô oszlopok elemeit, amelyek kémiai és optikai tulajdonságaikban homológoknak tekinthetôk, egyenes vonalak kötik össze. Azoknak az egymást követô elemeknek a sorozatát, amelyek belsô csoportjaik felépülését tekintve különleges helyet foglalnak el, vonalak keretezik.
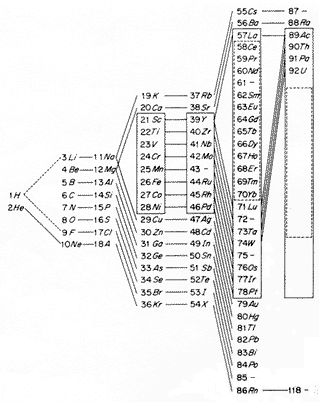
1. ábra
Az 1. táblázat legfontosabb jellegzetességei azokon az általános meggondolásokon alapszanak, amelyeket a fent említett cikk tartalmaz. A részletek kidolgozásában a spektrumok sorozatának alapos vizsgálata játszik fontos szerepet. Bár ezekbôl a spektrumokból is világosan kitûnik a belsô elektroncsoportok fokozatos képzôdése, a spektrumok sorozatából kapható közvetlen információ elsôsorban azoknak az új típusú elektronpályáknak a fokozatos megjelenése, amelyek a [csoport-]képzôdés lépéseit bevezetik. Ennek megfelelôen az 1. táblázat lényegében csak azokat az elemeket tünteti fel, amelyek a [csoport-] képzôdés elsô lépései. Amikor a spektrumokból nem vonható le egyértelmû következtetés a legkülsô csoportokban levô elektronok számára, a legmagasabb kvantumpályáknak megfelelô elektronok száma zárójelben szerepel. A csoportok további képzôdését csak a végeredmény, de a teljesen kialakult csoportok leírása is tartalmaz még bizonytalanságot; elsôsorban az ugyanabban a fôcsoportba és ennek alcsoportjaiba tartozó elektronmozgások kölcsönhatásának részletei várnak tisztázásra. [...]
A Röntgen-spektrumok osztályozása
Coster fent idézett dolgozatából más ismert, hogy igen sok elem esetében a Röntgen-spektrumok azon az alapon osztályozhatók, hogy az egyes vonalak n frekvenciája két spektrum-vonal[term], T' és T" különbségével reprezentálható. A vonalas spektrumok kvantumelméletének elveivel összhangban ezek a spektrum-termek - h-val megszorozva - egy olyan atom energiaszintjeivel értelmezhetôk, amely egy belsô csoport egyik elektronjának eltávolítása miatt kikerült a normális állapotból.
A 2. ábra a radon (86) nemesgáz várható karakterisztikus Röntgen-spektrumát mutatja. A spektrumvonalakat - a szokásos módon - függôleges nyilak jelölik, a vízszintes vonalak a szinteket jelzik. Az ábrán csak azok a vonalak szerepelnek, amelyeket a radon szomszédságában levô több elemre is kimértek, de a diagram azoknak az elemeknek a spektrumára is utal, amelyek a xenon és a kripton szomszédságában vannak. Azokat a szinteket, amelyek a kisebb atomszámú elemek felé haladva eltûnnek a radon (86) és a xenon (54) között, egyetlen függôleges vonal jelzi, a xenon (54) és a kripton (36) között eltûnô szinteket két vonal jelöli.
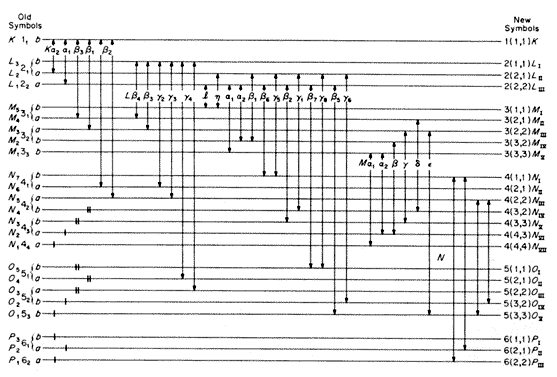
2. ábra
Az ábrából kitûnik, hogy a szintek jelei eltérnek az elôzô dolgozatokban használt jelektôl. Elôször is a szintek azonos csoportjához tartozó alszinteket római számok jelzik abban a sorrendben, amelyben - az atomszám növekedésének megfelelôen - fokozatosan megjelennek az elemek Röntgen-spektrumában. Azután minden szinthez tartozik egy n(k1,k2) alakú számcsoport. Késôbb részletesen tárgyaljuk a jelölések és az atomszerkezetre vonatkozó elmélet kapcsolatát. Itt csak arra szeretnénk rámutatni, hogy a 2. ábrán a három nemesgáz spektrumait reperezentáló szinteket azok az n és k értékek jellemzik, amelyek az 1. táblázatban a nemesgáz-elemek atomjainak elektronpályáihoz tartozó n és k kvantumszámok értékeiként jelennek meg. Az is megfigyelhetô, hogy a szintek közötti kombinációknak megfelelô vonalak megjelenésében az a szabály jut érvényre, hogy az átmenet folyamatában a k1 szám mindig egy egységgel változik, míg a k2 vagy eggyel változik, vagy állandó marad. Ezek a szabályok ekvivalensek azokkal a szabályokkal, amelyeket Coster korábbi munkájában a régi jelekkel fejezett ki, és formálisan pontosan megfelelnek azoknak a szabályoknak, amelyeket ugyanebben az idôben Wentzel fogalmazott meg. A k1-re és k2-re bevezetett numerikus értékek megegyeznek azoknak az n és m számoknak az értékeivel, amelyeket ez utóbbi szerzô a szintek osztályozására használt. A számok elméleti jelentôségét azonban egy kissé eltérô módon fogjuk értelmezni.
Az energiaszintek meghatározása a kísérleti anyagból
A Röntgen-spektrumok jelenleg rendelkezésre álló mérési adatai lehetôvé teszik, hogy igen pontosan meghatározzuk számos elem energiaszintjeit. ...
[Bohr és Coster ezután egy táblázatot közöl, amely más szerzôk kísérleti eredményeit tartalmazza. A különbözô elemek energiaszintjeit ennek a táblázatnak az adatai alapján számították ki a cikkben leírt módszerrel. E. Farber]
[1] N Bohr, Zeistschrift für Physik, Vol. 9 (1922), p. 1.
[2] D. Coster, Philosophical Magazine, Vol. 43 (1922), p. 1070; Vol. 44 (1922) p. 546
[3] Mint a Nap bolygói esetében.
| ChemoNet, 1997 | http://www.kfki.hu/chemonet/
http://www.ch.bme.hu/chemonet/ |