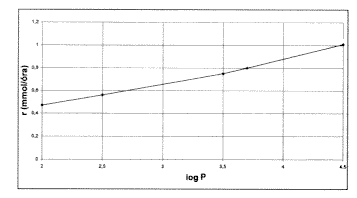
1. ábra. A 2-klór-propionsav-butil-észter képzôdésének
reakciósebessége
A fehérjemérnökség alternatívája
BAKÓ KATALIN – GUBICZA LÁSZLÓ
Sasvári Zsuzsanna: Méretre szabott fehérjék címû, a Természet Világa 1998. márciusi számában megjelent cikkének egyes gondolataira szeretnénk írásunkkal reagálni. A biotechnológiában, azon belül is a fehérje természetû anyagokkal foglalkozó tudományág berkein belül, egyre elfogadottabb a "fehérjemérnökség" (protein engineering) szóval illetett beavatkozás. Ahogy az a cikkbôl is kiderül, arról van szó, hogy napjainkban a szakemberek már képesek megtervezni, "legyártatni", méretre szabni (tailoring) a kívánt szerkezetû és funkciójú fehérjét. E folyamatban többnyire géntechnológiát alkalmaznak: a fehérjemolekulát kódoló génszakasz manipulálásával állítják elô a fehérjét. Van azonban emellett egy újabb eljárás is, amellyel az adott fehérje tulajdonságait lehet módosítani. Az eljárás során a fehérjét körülvevô környezeti tényezôk alakításával "kényszeríthetjük" a proteint, hogy a számunkra legelônyösebb módon viselkedjék. A folyamatot közeg- (medium-), illetve oldószermérnökségnek (solvent engineering) lehetne fordítani az angol kifejezések nyomán.
A környezet, amely a fehérjét körbeveszi, döntôen befolyásolja annak mûködését. Az oldószermérnökség ott játszik fontos szerepet, ahol a fehérje enzimként mûködik, vagy ahol a reakció, amit az enzim katalizál, szerves oldószerben zajlik.
Ez utóbbi még 15–20 évvel ezelôtt is szentségtörésnek tûnt az enzimológusok körében. Azóta azonban bebizonyosodott, hogy egyes enzimek kitûnôen mûködnek nemvizes közegben is. Ennek a felfedezésnek leginkább a szerves kémikusok örültek, hiszen lehetségessé vált az enzimes katalízis alkalmazása olyan reakciók esetén is, ahol a kiindulási anyagok nem oldhatók vízben!
Az egyik legismertebb, nemvizes közegben is alkalmazható enzim a lipáz. A reakció természetes közegében, a vízben a lipáz katalizálja az észter típusú vegyületek bontását, vagyis hidrolízisét, míg a szerves oldószerben fordított reakció játszódik le: észterek képzôdése. A veszprémi Mûszaki Kémiai Kutató Intézetben (MÜKKI) több mint 10 éve folynak ezen a területen kutatások. Az enzimológia e speciális ága annyira új, hogy még széles körben elfogadott nevezéktana sem alakult ki, illetve most dolgozzák ki a terminológiát.
A szerves oldószerekben zajló, lipázzal katalizált reakciók közül a MÜKKI-ben többek között a 2-klór- propionsav és az n-butanol észterezését vizsgáltuk. A reakció kezdeti sebessége (vagyis, hogy mennyire képes aktívan dolgozni az enzim) nagymértékben befolyásolható a megfelelô oldószer alkalmazásával. A szerves oldószerek egyik legjellemzôbb tulajdonságát, a hidrofobicitást az ún. log P érték jellemzi, amely – kissé leegyszerûsítve – azt mutatja, mennyire oldódik bennük a víz. Minél inkább hidrofób az oldószer, annál kevésbé oldódik benne a víz, s annál nagyobb a log P értéke. Az említett sav és alkohol reakcióját 0,5 és 4,5 közötti log P értékû oldószerekben vizsgáljuk (1. ábra). Látható, hogy az enzim aktivitása közel lineárisan nô az oldószer hidrofobicitásával.

1. ábra. A 2-klór-propionsav-butil-észter képzôdésének
reakciósebessége
Ez azzal magyarázható, hogy a kis Iog P értékû, hidrofil oldószerek elvonják az enzimtôl a mûködéséhez feltétlenül szükséges vizet. Az oldószer hidrofil jellegének csökkenésével ez a hatás gyengül. Tehát a jól megválasztott oldószerrel a reakcióhoz szükséges idô nagyságrendekkel csökkenthetô, s ez tetemesen növelheti a folyamat hatékonyságát.
A lipáz enzimes észterezést nem csak szintetikus célokra lehet felhasználni. Alkalmazható például ún. reszolválásra is, az optikai izomerek szétválasztására. Az izoméria azonos összetételû vegyületek közötti szerkezeti különbség. Egyik válfaja az optikai izoméria, amelynek képviselôi csak annyiban különböznek a párjuktól, mint a bal kéz a jobbtól. (A szerves kémiában R és S, illetve D és L betûkkel jelölik a két izomert. A D jelû vegyület jobbra, az L jelû balra forgatja a poláros fény ún. polarizációs síkját.) Szétválasztásuk éppen e hasonlóság miatt nehéz, ugyanakkor bizonyos esetekben igen fontos. Gyakran elõfordul ugyanis, hogy az optikai izomerek biológiai aktivitása különbözô. Számos ilyen példát ismer a gyógyszeripar (elég csak a híres-hírhedt Contergan-ügyre utalnunk).
A MÜKKI-ben folyó kutatások során enantioszelektív lipáz enzim segítségével olyan biokémiai reakciókat vizsgálunk, amelyekben az egyik optikai izomer észterképzõdési reakciósebessége sokkal nagyobb, mint a másiké. Így a két izomer elválasztása viszonylag egyszerûen megoldható: az enzimes észterezés után már
csak a maradék, reagálatlan savat és a képzôdött észtert kell szétdesztillálni. Az enzim enantioszelektivitásának mértéke a két izomer reakciósebességének az aránya, amely ugyancsak nagymértékben függ a körülményektôl, az alkalmazott oldószertôl. A nemzetközi szakfolyóiratokban elsôként számoltunk be arról, hogy az oldószerek log P értéke, s a szétválasztást katalizáló enzim enantioszelektivitása között közel lineáris az összefüggés (2. ábra). Mit is jelent ez? Azt, hogy a kevésbé hidrofób oldószerekben az egyik (pl. R) izomer sokkal könnyebben reakcióba vihetô (kezdeti reakciósebessége két nagyságrenddel nagyobb), mint a másik. Így a két reakciósebesség aránya a 100-hoz (!) közelít. Ezzel elérhetô, hogy a kapott termékben szinte kizárólag az egyik izomer forduljon élô: így a szétválasztást megoldottuk. Ugyanakkor a nagyobb log P-jû oldószereknél a két izomer enantioszelektivitása 10 alatti, vagyis jóval kisebb.
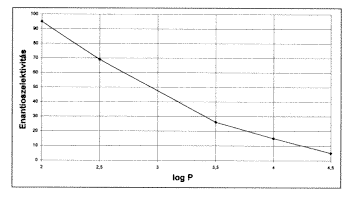
2. ábra. Az enantioszelektivitás függése
az oldószer hidrofobicitásától
A jelenségnek (vagyis annak, hogy a kisebb log P-jû oldószerekben nagyobb az enantioszelektivitás) magyarázata az, hogy a hidrofil oldószerek (kis log P) a már emlitett vízelvonással merevebbé teszik az enzim belsô szerkezetét. A merev enzimszerkezet pedig egyre kevésbé képes a sztérikus okokból számára egyébként is nehezen hozzáférhetô S-izomer átalakítását katalizálni. A két ábra összevetésébõl az is megállapítható, hogy a log P növelése az aktivitást és az enantioszelektivitást ellentétes irányban befolyásolja. Az optimális oldószer megválasztása így körültekintô munkát igényel.
Az oldószermérnökség alkalmazásánál felhasznált jelenségek mindegyike az enzim konformációjának (belsô szerkezetének) változására vezethetô vissza. Úgy tûnhet, hogy ezen alapkutatási eredmények, megfigyelések ipari hasznosítása még messze van. Ezt cáfolandó, szintén a MÜKKI-ben kidolgoztunk egy félüzemi méretû, szerves oldószerben történô, enzimes észterezést alkalmazó eljárást, amellyel természetes aroma- és illatkomponensek állíthatók elõ. Ezzel azt is bebizonyítottuk, hogy a még gyermekcipôben járó oldószermérnökség "tudománya" nem elefántcsonttoronyban élõ kutatók öncélú ténykedése, hanem olyan tevékenység, amelynek eredményei a gyakorlat, az ipar számára is fontosak. Meggyôzôdésünk, hogy a következõ években egyre több, az oldószermérnökség ismereteit is felhasználó "biotermékkel" fogunk találkozni az élet sok területén.
Az enantioszelektivitás a katalizátorok,
enzimek tulajdonsága, válogatást (szelektálást)
jelent, vagyis enzimek az optikai izomerek közül csak az egyik
átalakulását, reakcióját katalizálják.
| Vissza az Elõadóba | http://www.kfki.hu/chemonet/
http://www.ch.bme.hu/chemonet/ |