 |
 |
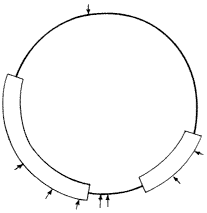
| 1. ábra. Egy sematikus vektor
ábrája. A nyilak a restrikciós endonukleázok hasítóhelyeit jelölik |
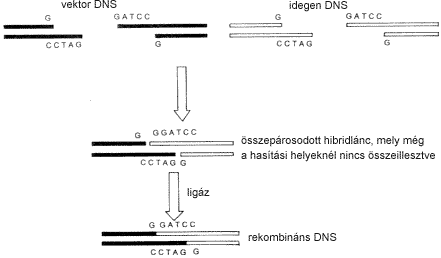
2. ábra. Idegen DNS beépítése ragadós vég képzéssel |
Méretre szabott fehérjék
Mi is az a fehérjemérnökség?
SASVÁRI ZSUZSANNA
Az ember alapvetô és megváltoztathatatlan jellemvonása,
hogy mindent a saját szolgálatába akar állítani.
Lehetôségeihez mérten a természetet is maximálisan
kihasználja, felhasználja, sôt át is alakítja.
Így indult útjára a "mérnökösködés"
már évezredekkel ezelôtt. Napjainkra az élô
szervezet bonyolult mûködésében szerepet játszó
összetett molekulák (fehérjék, DNS) is a tervezôk
asztalára kerültek, hogy akár a gyógyászatban,
akár az ipar számos területén az emberiség
igényeit kielégítve végezzék feladatukat.
Mi is az, amit meg szeretnénk változtatni és miért?
A fehérjék (proteinek) funkciója igen széleskörû. Részt vesznek a sejtek szerkezetének felépítésében, a sejtek közti információ- és az anyagszállításban. Talán nincs is olyan biológiai folyamat, amelyben fehérjekatalizátorok, vagyis enzimek ne vennének részt. Így tervezésük során többféle tulajdonságukat is megcélozhatjuk. Változtathatunk a fehérje stabilitásán, befolyásolhatjuk a végsô szerkezet kialakításának (folding*1) folyamatát, módosíthatjuk a molekuláris felismerést, a receptorhoz való kötôdést, a szubsztrát-specificitást, valamint a fehérje más fehérjére, ill. az aktív helyhez kötôdni képes molekulákra irányuló kölcsönhatását.
Ha csupán az enzimkereskedelem piacára irányítjuk figyelmünket, szinte hihetetlennek tûnik, hogy a különbözô enzimek iránti kereslet az Egyesült Államokban 1992 és 1997 között évente mintegy 10%-kal nôtt, ami számszerûen kifejezve közel 1 milliárd dollárt jelent. Az egész világot érintve a piac természetesen lényegesen nagyobb, ebben Európáé a vezetô szerep.
A mikroorganizmusok által termelt saját fehérjék, illetve az általuk termeltetett, esetleg már módosított fehérjék két jelentôs irányban hasznosíthatók. Az egyik az enzimek ipari felhasználása, mint például az alfa-amiláz, glükoamiláz, glükóz/xilóz izomeráz enzimhármas, amelyek segítségével keményítôbôl izocukorszörp állítható elô. Gondolhatunk a különbözô proteázokra is, amelyeket tisztítószerekhez adnak a mosóhatás fokozására. A másik irány a proteinek gyógyászati célú felhasználása. Erre példa az emberi növekedési faktor gyógyszerkénti alkalmazása, pl. a törpenövés ellen vagy az inzulinadagolás cukorbetegség ellen. Ide sorolhatjuk a haemophilia kezelésére szánt VIII-as véralvadási faktort, ami még a klinikai tesztelés fázisában van, vagy az AIDS kezelésére szolgáló erythropoietint is. A biotechnológiai alapú gyógyszereknek nagy jelentôségük van (sok-sok más mellett) a szív és a keringési rendszer betegségeinek gyógyításában, a reumatikus panaszok kezelésében és a rák elleni terápiában is.
A fehérjék stabilitásának növelése során például különbözô szokatlan környezet elviselésére (magas hômérséklet, extrém pH és redoxpotenciál, szerves oldószer) próbáljuk "szoktatni" a molekulát. Vegyük például a hôstabilitás kérdését. Választhatnánk olyan enzimet, amely a különleges környezetet, vagyis a magas hômérsékletet kedvelô mikroorganizmusból származik (ilyen a Therratoga maritima). Ám ezek az enzimek az átlagos hômérsékletû (30–50 oC) körülmények között csökkent aktivitásúak. Igen jó példa erre a keményítô ipari feldolgozásában (lebontásában) használt glükoamiláz, ami a már határdextrinekre bontott keményítôbôl glükózt szabadít fel. Mûködésének optimális hômérséklete 50 oC, míg az az enzim, amely a határdextrineket hozza létre, 90 oC-on a legaktívabb. Ha rendelkezésünkre állna ennek az enzimnek a hôstabilabb változata, a reaktor lassú hûlése közben a hôstabil glükoamiláz – amely 90 oC-on éppoly aktív, mint 50 oC-on – tovább hasíthatná a határdextrineket. Vagyis így egy költséges hôcserélési lépés válna szükségtelenné. A közepes és magas hômérsékleti környezetben élô baktériumokból származó enzimeknél jelentôs felépítési különbségek találhatók. A hôstabilak globuláris szerkezetének kialakulása, formálódása során képzôdött belsô üregek mérete és száma például jelentôsen kisebb. Több bennük a H-híd és az ionos kötés is. Elôfordul, hogy 18 aminosav van egymással ionpárban. A hajtûszerûen hajlított szakaszok (loopok*2) rövidebbek, vagy a C-, vagy az N-terminális felôl rövidül le a polipeptidlánc. Továbbá tipikus aminosavcseréket fedeztünk fel bennük: glicin helyett alanin található a hôtûrô változatban. Ennek egyik magyarázata az lehet, hogy ha a nagyobb méretû alanin épül be glicin helyett a peptidláncba, csökken a szerkezet rendezetlensége (konformációs entrópia), vagyis a molekula rigidebbé, merevebbé válik. Így lesz ellenállóbb a magas hômérséklet okozta fokozottabb szerkezeti változásokkal szemben. Más esetben viszont azt figyelték meg, hogy hôstabil enzimnél a hisztidint és a glicint az arginin helyettesíti. E jelenségnek oka az lehet, hogy az arginin erôsebb sókötéseket formál, mint a hisztidin vagy a glicin, tehát erôsíti a stabilitás szempontjából igen fontos ionos kapcsolatokat.
Ezek fényében melyek lehetnek a stabilitást növelô eljárások?
1. Stabilizálás során az enzimet valamilyen eljárással rögzítik a vízben oldható vagy oldhatatlan anyagokhoz. Létrehozhatnak szintén vízben oldható vagy oldhatatlan óriáspolimereket azáltal, hogy a fehérjemolekulákat két reaktív csoporttal rendelkezô (bifunkciós) reagenssel kovalensen kapcsolják össze. A polimereket ezen kívül még valamilyen gélbe vagy mikrokapszulába is ágyazhatják. Ha a kérdéses enzim sokkal stabilabb a sejtben, mint tisztítás után, két lehetséges megoldás kínálkozik. Az egyik, hogy a teljes sejtet polimergélbe ágyazzák, így fennmarad az enzim számára a saját, természetes stabilizáló makrokörnyezet. A másik, hogy megpróbálják az enzim természetes közegét mesterséges módon elôállítani. Ilyenkor pl. a membránhoz kötött fehérjét valamilyen hidrofób anyaghoz rögzítik.
2. Egy lehetôség az is, ha az enzimet kémiailag módosítják. Bármely olyan aminosavat, amely aminocsoport oldalláncot hordoz, amidinálással vagy guanidinálással argininhez hasonló szerkezetûvé tehetünk annak érdekében, hogy az említett, természetben megfigyelt jelenséget mesterségesen elôidézzük. Próbálkozhatunk alkilálással vagy akár acilezéssel is, de ezeknél elôfordul, hogy éppen destabilizáló hatást érünk el.
3. Elterjedt megoldás a különbözô adalékok (additívek), mint például cukrok és más poliolok (glicerin, glikol) alkalmazása is, mivel ezen molekulák tovább erôsítik a stabilitás szempontjából amúgy is kulcsszerepet játszó hidrofób kölcsönhatásokat.
A mérnöki beavatkozás legjárhatóbb útja azonban az, ha megtaláljuk a fehérjemolekulát kódoló génszakaszt és ezen a génszakaszon hozunk létre mutációkat oly módon, hogy az a fehérje tulajdonságát igényeink szerint befolyásolja.
Hogyan hozzuk létre a génmutációkat?
A gént, amely a kérdéses fehérjét
kódolja, klónozzák. Ennek során a kérdéses
fehérje génjét egy úgynevezett klónozó
vektorba ültetik. A klónozó vektor nem más,
mint egy olyan DNS, amely replikációs kezdôpontot (origót)
tartalmaz,
és replikálódni tud a választott gazdasejtben.
Leggyakrabban a baktérium citoplazmájában önmagától
replikálódni képes, kör alakú DNS (plazmid)
a
választott hordozó (1. ábra).
Az idegen DNS-t
(vagyis azt a nukleinsavszakaszt, amely tartalmazza a vizsgált fehérje
génjét) enzimek (endonukleázok)
segítségével
juttatják a kör alakú DNS-be, a vektorba. Némely
enzim a vektor két DNS-láncát néhány
bázispárral eltólódva hasítja, vagyis
ragadós végeket (sticky ends) hoz létre. Az
idegen DNS darabját és a vektort ugyanazzal az enzimmel hasítják,
így az a komplementer (egymást kiegészítô)
bázisok összekapcsolódásával beépül
a kívánt DNS-be, melyet végül a ligáz
nevû enzimmel kapcsolnak a vektorhoz (2. ábra). A létrejött
rekombinánsokat aztán a gazdasejtbe telepítik. A transzformálás
során a kiválasztott baktérium-gazdasejt szuszpenziót
összekeverik a rekombináns DNS-sel. Az, hogy milyen módon
jut a DNS a gazdasejtbe, még ma sem igen ismert mechanizmus.
 |
 |
| 1. ábra. Egy sematikus vektor
ábrája. A nyilak a restrikciós endonukleázok hasítóhelyeit jelölik |
2. ábra. Idegen DNS beépítése ragadós vég képzéssel |
Ha a protein génjének klónja már rendelkezésre áll, tetszôlegesen lehet mutációkat, deléciót*3(törlés), inzerciót*4 (beépítés), szubsztitúciót*5(helyettesítést) végezni rajta. Ezzel bármilyen klónozott DNS-darabot bármilyen kívánt szakaszra ki lehet cserélni. A mesterségesen irányított mutagenezis lépései röviden összefoglalva a következôk: (1) Egyszálú, rövid DNS-darabot, úgynevezett oligot szintetizálnak, mely tartalmazza a kívánt mutációt, máskülönben teljesen komplementer a fehérjét kódoló génszakasszal. (2) A primerként*6 szolgáló oligot hibridizáltatják a klónozott egyszálú DNS-sel. (3) Az így létrejött heteroduplexet pl. Escherichia coli baktériumba transzformálják, ahol replikálódik. Habár statisztikailag a replikátumoknak mintegy fele tartalmazza a kívánt mutációt, valójában a gyakoriság sokkal kisebb ennél. Így olyan sejtvonalakat (mutator strains) használnak, amelyek hibás javítómechanizmussal rendelkeznek*7. (4) Ezután szelektálják a mutánsokat. Az egyik lehetôség az, hogy a mutáns szálat szekvenálják, vagyis bázissorrendjét meghatározzák. Ezáltal pontosan meghatározható, hogy valóban beépült-e a kívánt mutáció.
Nem csupán irányított, de véletlen (random) mutációt is indukálhatunk. Ennek elônye, hogy igen egyszerûen létrehozható (kémiai mutagén anyagokkal, sugárzással vagy mutatorvonalakkal), de mivel a mutáció nem ellenôrzihetô, igen nagy számú mutációt kell analizálni ahhoz, hogy a kapott eredmények értékelhetôk legyenek. A génmutáció pontos tervezéséhez fontos, hogy minél részletesebben ismerjük a fehérje teljes szervezôdését, harmad-, illetve negyedleges struktúráját. Ennek leggyümölcsözôbb módja, ha ismerjük a fehérje kristályszerkezetét valamilyen fehérjéhez kötött molekula ligandum (szubsztrát, inhibitor) jelenlétében. Speciális spektroszkópiai eljárások (cirkuláris dikroizmus spektroszkópia*8, illetve NMR-spektroszkópia*9)segítségével is egyértelmû információkat kaphatunk errôl. Ezek nagy hátránya azonban, hogy igen nagy töménységû, teljesen homogén fehérjére van szükség a kísérletek végrehajtásához. További megoldásokat találhatunk szekvencia-homológia keresésével. Vagyis ha ismerjük egy rokon fehérje térszerkezetét és az aminosavak sorrendjét, és azt a kérdéses fehérje aminosav-szekvenciájával összehasonlítjuk, megkereshetjük a mutagén beavatkozásra legmegfelelõbb helyeket. Fontos, hogy minél kevésbé bontsuk meg a fehérje eredeti térszerkezetét, nehogy a mutáció hatására bekövetkezett változásokat tévesen értelmezzük, azaz nehogy funkcionális szerepet tulajdonítsunk egy adott aminosavnak vagy peptidszakasznak, holott csupán a fehérje térszerkezetének (konformációjának) drasztikus módosulásából származnak a megváltozott tulajdonságok. E szekvencia homológia keresés közben meghatározhatjuk az evolúciósan erôsen konzervatív*10 és egyáltalán nem konzervatív aminosavakat is. Az elõbbieknek valószínûleg nagy szerepük van az adott protein funkciójában, míg a nem konzervatív szakaszok az egyes proteinekre egyedileg jellemzô tulajdonságokat, például szubsztrát-specificitást határozhatnak meg. Rokon, de különbözô specificitású fehérjék szekvenciáit összehasonlítva olyan aminosavcsoportokat (néha nagy doméneket*11) is felcserélhetünk, melyek az eltérô tulajdonságokért felelôsek. Ehhez azonban az szükséges, hogy az öszehasonlított fehérjék szerkezetét ismerjük, vagy hogy egy tökéletesen felismerhetô motívumot*12 találjunk. Így készíthetünk hibrid proteint. Ily módon kapcsolták össze pl. a Bacillus maceranstól származó b-glükanáz C-terminálisának szegmentjét és a Bacillus amyloliquefacienstôl származó b-glükanáz N-terminális részét annak érdekében, hogy a hô- és savtoleranciát egyetlen fehérjébe párosítsák*13.
Mint láthatjuk, a fehérjemérnökség igen komplex tudományág. Nem csupán az enzimek, hanem a protein alapú reagensek (pl. interferonok, humán növekedési faktor), ellenanyagok újratervezése is modern életünk követelménye. A gyógyászatban, az élelmiszeriparban, de az egyre halmozódó mérgezô végtermékek bontásának környezetbarát megoldásában is nélkülözhetetlen a fehérjéket átalakító mérnöki munka.
SZÓSZEDET
*1. folding = szó szerint hajlítás, tekerés. Amíg a fehérje a transzlálódástól eljut a végsõ globuláris állapotig, jelentôs konformációváltozáson, 'hajlítgatáson' megy keresztül. Igen leegyszerûsítve úgy képzelhetô el e folyamat, mintha egy hosszú, nyújtott fonalat valamilyen szabály szerint összegyúrnánk.
*2. loop = hurok. A fehérjének azon jellegzetes szakasza, mely sem a-hélixbe, sem b-redôbe nem rendezôdik.
*3. deléció = Egy bizonyos hosszúságú szakasz kitörlése a DNS-láncból.
*4. inzerció = Egy bizonyos hosszúságú nukleotid szakasz beültetése a DNS-láncba.
*5. szubsztitúció = Bizonyos bázisok kicserélôdése.
*6. primer = Azon rövid nukleinsavszakasz, melyrôl a replikáció kezdôdik.
*7. javító mechanizmus = Az élô sejtekben vannak olyan enzimek (endonukleáz, DNS-polimeráz, ligáz), melyek feladata részben a hibásan beépülô nukleotodik felismerése, kivágása, majd az immáron megfelelôre kicserélt nukleotid 'beragasztása'. Ily módon csökken az esélye, hogy esetleges súlyos következményekkel járó mutációk jelenjenek meg.
*8. Cirkuláris Dikroizmus (CD) spektroszkópia olyan spektroszkópiai eljárás, amely segítségével az oldatban levô fehérje másodlagos szerkezetérôl kaphatunk információkat.
*9. A Nukleáris Mágneses Rezonancia (NMR) olyan spekroszkópiai eljárás, amellyel az oldatban lévô kisméretû fehérjék másodlagos szerkezetére következtethetünk.
*10. domén = egy fehérjemolekulán belül elôforduló funkcionálisan és strukturálisan jól elkülöníthetô alegység.
*11. motívum = Olyan tipikus peptidlánc-konformáció, mely a legkülönfélébb funkciójú fehérjékben megtalálható.
*12. Olsen O., Borriss R., Simon O., Thomsen K. K.: Hybrid Bacillus (1-3, 1-4)-b-gluconases: Engineering Thermostable Enzymes by Construction of Hybrid Genes. Mol. Gen. Genet. 1991, 225: 177-185
*13. Levin, L. L., Kuret, J., Johnson, K. E., Powers, S., Michaeli, T, Wigen, M., and Zoller, M. J.: A mutation in the catalytic subunit of cAMP-dependent protein kinase that disrupts regulation. Science 1988, 240: 68
| Vissza az Elõadóba | http://www.kfki.hu/chemonet/
http://www.ch.bme.hu/chemonet/ |