Az áramot és a reakciósebességet befolyásoló tényezôk
Tekintsük az O + ne « R reakciót: az oldott O komponens a szintén oldott állapotba kerülô R komponenssé való redukálását. Egy sor közbensô lépésre is szükség van (az elektrokémiai reakció heterogén volta miatt) – ezek az alábbiak szerint csoportosíthatók (3. ábra):
- Anyagtranszport (pl. az O komponensnek az oldat belsejébôl el kell jutnia az elektród felületéhez).
- Elektronátlépés (ez a tulajdonképpeni kémiai reakció).
- Az elektronátlépést megelôzô vagy követô kémiai reakciók. Ezek között homogén és heterogén reakció egyaránt lehet (pl. protonálódás, dimerizáció vagy katalitikus bomlás).
- További, a felülethez köthetô folyamatok (adszorpció, deszorpció, kristályosodás).
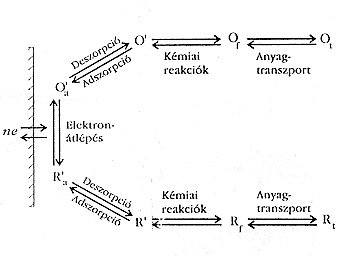
3. ábra
Ha a különbözô folyamtok izoláltan, önmagukban mennének végbe, sebességük különféle lenne. Mivel most sorban egymás után zajlanak, a teljes folyamat sebességét a "leglassúbb" részfolyamat sebessége korlátozza. Stacionárius állapotban tehát valamennyi lépés sebessége egyforma, és ezt a sebességet a sebességmeghatározó lépés "átbocsátó képessége" szabja meg. Gyakran elôfordul pédául, hogy az egyébként gyors kémiai reakció mégsem megy végbe a várt sebességgel, mert a sebességmeghatározó lépés a reaktánsok diffúziója.
Az elektrokémiai reakciók kinetikájának vizsgálata a homogén reakciók esetétôl három jellegzetes ponton különbözik.
- A reakciósebesség arányos a Faraday-árammal, tehát közvetlenül mérhetô. A homogén kinetika esetében többször nem magát a sebességet, hanem a koncentrációk idôfüggését mérjük, és ebbôl áll elô – idô szerinti deriválással – a sebesség.
- A sebességi egyenletekben nem a komponensek koncentrációjának oldatbéli, hanem a felületi értékei számítanak. A kétféle koncentráció – például az imént említett anyagtranszport hatása miatt – jelentôsen különbözô lehet.
- Az elektrokémiai reakciók sebességi együtthatója – mivel töltött részecskék reakciójáról van szó – a reakció helyén uralkodó elektromos potenciáltól is függ.
Az alábbiakban arra keressük a választ: miért és hogyan függ az elektrokémiai reakciók sebessége az elektród potenciáljától, ill. a túlfeszülstégtôl, elôtte azonban kis kitérôt teszünk, és összefoglaljuk a homogén reakciókinetika néhány, számunkra fontos alapfogalmát.