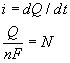 14.
14.Polarizáció és túlfeszültségMielôtt az egyszerû elektrokémiai rendszerek tárgyalásába fognánk, vizsgáljuk meg közelebbrôl az elektródpotenciál és a cellában átfolyó áram kapcsolatát. Tekintsünk egy 1 M Cd(NO3)2-oldatba merülô Cd-elektródot, a másik félcella pedig legyen egy telített kalomelelektród. A cella egyensúlyi (árammentes) potenciálja (körülbelül) 0,64 V lesz, a Hg és a Cd kivezetései közül az utóbbi lesz a negatív. Ha külsô áramforrásból pont ezt az Ek feszültséget adjuk a cellára, semmi nem változik, az áram változatlanul zérus marad. Ha Ek > 0,64 V (azaz a Cd-elektród a kalomelhez képest még negatívabbá válik), a cella elektrolizáló cellaként mûködik, és áram fog átfolyni rajta. A Cd-elektródon a Cd2++2e® Cd reakció játszódik le, a kalomelen a Hg oxidálódik Hg2Cl2-vé. Felvetôdik a kérdés: ha Ek értéke - mondjuk - 0,74 V, mekkora áram folyik a cellán? Mivel i a másodpercenként a Cd2+-ionokkal reagáló elektronok számával arányos, az áramot firtató kérdés ugyanaz, mintha azt kérdeznénk: mekkora a Cd2++2e® Cd reakció sebessége?
A Faraday-áram és az elektrolízis sebessége közötti egyenes arányosságot a következô egyszerû módon fejezhetjük ki:
14.
ahol F a Faraday-állandó (egy mólnyi elektronnak megfelelô töltés), n a reakciólépésben résztvevô elektronok száma (tehát a Cd2++2e® Cd reakció esetén n = 2), N pedig az elektrolízis során átalakult mólok számát adja. Kézenfekvô a reakció v sebességét a mólszám változási sebességével mérni:
15.
A képletben a v dimenzióját is feltüntettük, a következô okból. Egy heterogén rendszerben lezajló folyamat sebességének definícióját a homogén esethez képest (többek között) azért is nehezebb megadni, mert itt a határfelület nagyságát is tekintetbe kell vennünk. A reakció sebességét jellemzô mennyiségtôl megkívánjuk, hogy ne függjön a rendszer méretétôl. A reakciósebességet ezért az elektród egységnyi felületére vonatkoztatjuk:
16.
ahol a felületet A jelöli, és bevezettük az i áram mellett a j áramsûrûséget.Az elektródreakciót gyakran úgy próbáljuk jellemezni, hogy mérjük az i áramot az E potenciál függvényében: ezt az i(E) polarizációs görbének nevezzük. Az elektródpotenciál (vagy a cellapotenciál) eltávolítását az egyensúlyi (nerensti) értéktôl polarizációnak nevezzük. Minél nagyobb az egyensúlyi értéktôl az eltérés, annál nagyobb a polarizáció. Korábban láttuk az ideálisan polarizálható elektród példáját: ezen keresztül csak elhanyagolható nagyságú áram folyik, ha az elektródot tág határokon belül polarizáljuk, és az i(E) görbe gyakorlatilag vízszintes. A másik szélsô esetnek a nempolarizálható elektród felel meg: ebben még nagy áram áthaladása sem változtatja meg számottevô mértékben az elektród polarizációját, az i(E) görbe tehát szinte függôleges.
A polarizáció mértékét túlfeszültségnek nevezzük, és
-val jelöljük:
17.
A túlfeszültség tehát a cellapotenciál eltérése az egyensúlyi értéktôl.