![]() (3)
(3)
3. Galvánelem elektromotoros ereje
A galvánelem elektromotoros erejét az alábbi meggondolásokkal számíthatjuk ki:
A galvánelem, mint rendszer, DU belsô energiájának (reverzibilis) megváltozása a rendszerrel közölt q hômennyiség és a w munkavégzés összege:
![]() (3)
(3)
Az elsô tag állandó hômérsékleten
q=TD
S, a másikkal kapcsolatban
tételezzük fel, hogy csak térfogati munkából
és a rendszeren végzett elektromos munkából
áll, azaz állandó nyomáson w=-PD
V+wel. Így,
behelyettesítéssel és átrendezéssel
azt kapjuk, hogy állandó nyomáson és hômérsékleten
![]() (4)
(4)
A rendszer által végzett elektromos
munka (-wel) a fenti galvánelem esetében
egyszerûen számítható: legyen R elegendôen
nagy, hogy U és E ne különbözzenek
számottevôen (és így a rendszer egyensúlyinak
legyen tekinthetô); folyjon I áram az ellenálláson,
vagyis D
t idô alatt haladjon át Q=IDt
töltés; ekkor az ellenállásban D
E·I·D
t=D
E·Q=-wel hô fejlôdik (ennyi
elektromos munka alakul hôvé). 1 mól anyag elreagálásakor
a külsô körön Q=nF töltés
halad át, ahol F a Faraday-állandó, azaz egy
mól elektron töltésének abszolút értéke,
és n a folyamatban résztvevô elektronok sztöchiometriai
száma. Mindezeket figyelembe véve, a 3. egyenlet az alábbi
alakban írható át:
![]() (5)
(5)
A 4. egyenlet szerint a cella elektromotoros
ereje egyenesen arányos a cellareakció szabadentalpiaváltozásával;
ezen egyenlet birtokában valamely redoxreakció D
GT,P szabadentalpia-változása igen egyszerûen
meghatározható a megfelelô galvánelem elektromotoros
erejének megmérésével. További termodinamikai
mennyiségek, D
HT,P és D
ST,P is meghatározhatóak D
E mérésével az alábbi egyenletek alapján:
![]() (6)
(6)
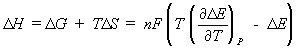 (7)
(7)
A reakció egyensúlyi állandója
is meghatározható az elektromotoros erô ismeretében,
ugyanis
![]() (8)
(8)