Martos János1, Zaránd Pál2
1Országos Idegsebészeti Tudományos Intézet
2Fővárosi Onkoradiológiai Központ, Uzsoki Utcai Kórház
Az MR (mágneses rezonancia) képalkotás az 1970-es évek nagy jelentőségű
felfedezése volt. A klinikai gyakorlatban az 1980-as években terjedt el.
Működésének alapja az 1946-ban leírt ún. mágneses magrezonancia (nuclear
magnetic resonance, NMR) fenomén.
Az MR alapvetően tomográfiás eljárás, tehát segítségével a CT-hez hasonlóan
szeletkép-sorozatok készíthetők, de az egyik lényeges különbség éppen az,
hogy nemcsak transzverzálisan (mint a CT-vel), hanem bármilyen síkban.
Ráadásul az MR többféle olyan, egymástól teljesen különböző kontraszttartalmú
felvétel készítésére alkalmas, amelyek a szövetek legkülönfélébb biokémiai,
biofizikai tulajdonságait tükrözik. Az orvosi képalkotó diagnosztikában
a felhasználási lehetősége már ma is óriási, de fejlesztése továbbra is
intenzíven folyik, szinte naponta születnek új mérési módszerek, melyek
folyamatosan kerülnek klinikai alkalmazásra, egyre nagyobb területet kanyarítva
le a többi képalkotó modalitástól.
Az MR berendezés
Az MR készülék fő része a mágnes, ami úgy van kialakítva, hogy a beteg
a mágneses tér közepén fekve helyezkedhessen el. Technikailag kétféle típus
létezik, az alagút rendszerű és az ún. nyitott mágnes (1. ábra). Az alagút
tulajdonképpen egy tekercs, ennek a közepe szolgál a pacienstér számára,
ami meglehetősen szűk, klausztrofóbiás beteg számára nehezen elviselhető.
A tekercs szupravezető anyagból készül, amit héliumfürdő tart az abszolút
nulla fok közelében.
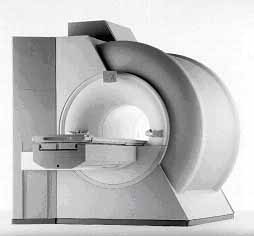
1. ábra. Alagút rendszerű 1.5 Teslás MR berendezés.
A nyitott mágnes kissé kényelmesebb az alagúthoz képest, ami a klausztrofóbiás,
vagy rossz állapotú betegek és a gyermekek vizsgálata szempontjából előnyt
jelent. Az alagút rendszerű, szupravezetős mágnes térereje általában nagyobb,
1.0, 1.5, 3 Tesla térerejű készülékek vannak forgalomban. A nyitott mágnes
térereje ennél jóval kisebb (0.1-0.3 Tesla), bár újabban készítenek közel
1.0 Tesla térerejű nyitott mágneseket is szupravezetős technikával.
A térerő az MR berendezés egyik legfontosabb jellemzője, mivel erősebb
mágneses térben a nyerhető jel lényegesen nagyobb, így jobb minőségű MR
képeket kaphatunk, és a mérés is rövidebb ideig tart.
A gradiens tér szerepe
Ahhoz, hogy az MR vizsgálat képet formáljon, a detektált NMR jelet
a képpont méretének megfelelő pontossággal lokalizálni kell. A lokalizációt
a gradiens terek segítségével végezzük. A gradiens téret megfelelő kialakítású
elektromágnesek hozzák létre, méghozzá a tér három irányában. A gradiens
tér minősége az MR készülék másik legfontosabb mutatója.
A gradiens tekercsekre adott nagy áramerősségű impulzusok miatt az
MR berendezés mérés közben igen hangosan zakatol. A gradiens impulzusoknak
a jel-lokalizáción kívül több más funkciója is lehet, pl.: a protonok reszinkronizációja
(gradiens-echó), mozgási artefaktumok csökkentése (GMR), diffúziósúlyozás,
stb.
Az MR képek kontrasztja
Az MR alatt ma a proton (hidrogén-atommag) NMR képalkotást értjük.
Az élő szervezetben a hidrogén - elsősorban a víztartalom miatt - nagy
koncentrációban van jelen, de a zsírok, fehérjék és szénhidrátok hidrogéntartalma
is jelentős. Az MR kép kontrasztját a protonok három alapvető tulajdonsága
befolyásolja: a protonok sűrűsége, a T1 és T2 relaxációs idő. Az echó generálását
különféle impulzusszekvenciák végzik, melyek a három paramétert különféle
mértékben súlyozzák, így T1-súlyozott, T2-súlyozott és protondenzitású
képek készíthetők (2.a., b., c. ábra). Az MR képek kontrasztját sok egyéb
paraméter is befolyásolja, elsősorban a szövetek mágneses inhomogenitása,
a hőmérséklet, különféle mozgások, mint például a szöveti diffúzió, a véráramlás,
stb. A különböző szekvenciák gyorsaságban és néhány speciális tulajdonságban
térnek el egymástól, melyek segítségével a fenti paraméterek erőteljesebben,
vagy gyengébben érvényesülnek a képalkotásban. A szekvenciákat általában
e speciális tulajdonságok alapján szokás elnevezni: pl. szuszceptibilitás
MR képalkotás, MR-angiográfia, MR spektroszkópiás képalkotás, perfúziós
MR, diffúziós MR, funkcionális MR, kinematikus MR, stb.
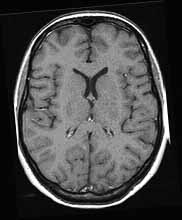
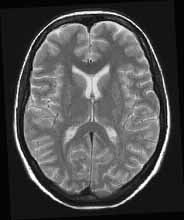
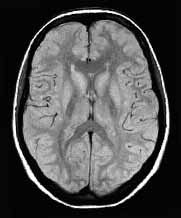
a
b
c
2. ábra. T1-súlyozott (a), T2-súlyozott (b) és protondenzitású (c)
szeletkép a nagyagy területéről.
Egy MR vizsgálat során általában több síkban készítünk felvételeket
a térbeli kiterjedés pontos meghatározására, ugyanakkor a felvételek többféle
szekvenciával, tehát más és más kontraszttartalommal is készülnek (3. ábra).
A különféle kontraszttartalmú képek segítségével nyert információk
az agyi felvételeken jól követhetők: a T1-súlyozású felvételeken a liquor
fekete, a zsír fehér, a szürke és fehérállomány jól elkülönül, a szürkeállomány
sötétebb, mint a fehérállomány. A T1-súlyozott felvételek általában részletdúsak,
ezért kiválóan alkalmasak az anatómiai viszonyok megítélésére. A T2-súlyozott
felvételeken a víz fényesen ábrázolódik, ezért a liquor fehér, a léziók
nagy része a megnövekedett víztartalom miatt jól differenciálható. Az agy
esetében a T2-súlyozású felvételeken a szürkeállomány világosabb a fehérállománynál.
A protondenzitású felvételeken a szabad víz és az ödémákra jellemző kötött
víz elkülönül, a szabad víz sötétebb, ezért a folyadéktartalmú részletek
(pl. ciszternák) elkülöníthetők a szolid lézióktól, mely utóbbiak élénk,
világos színűek (Atlas, 2003).
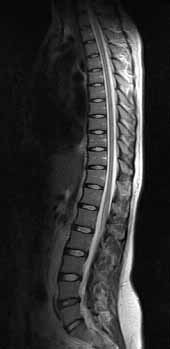
3. ábra. Thoracalis-lumbalis gerinc T2-súlyozott sagittalis felvétele.
Az MR képeken a világosabb struktúrákat hyperintensnek (jelgazdagnak), a sötétebbeket hypointensnek (jelszegénynek) írjuk le, isointens a terület, ha világossága nem tér el a környezetétől.
Szekvenciák
A már hagyományosnak számító spin-echó technikával jó minőségű és jó
kontrasztú képeket nyerünk, de sajnos a vizsgálat időtartama néhány percig
is eltart. A gyors spin-echó technikával ugyan a vizsgálatot 2-8-szorosára
lehet gyorsítani, de a gyorsaság a képminőség rovására megy. Az ún. gradiens-echó
technikákkal ennél gyorsabban, általában egy percen belül kapunk képeket,
az echó planár technika (EPI) mérési ideje pedig jóval egy másodpercen
belül marad.
A spin-echó (SE) szekvencia egy ún. 90 fokos, gerjesztő rádiófrekvenciás
impulzussal kezdődik, majd a protonok reszinkronizációját egy 180 fokos
rádiófrekvenciás impulzus végzi (4. ábra). A jel a gerjesztés után, az
ún. echó idő (TE) elteltével jelenik meg (Stark, 1999). Jellegzetessége
az igen jó képminőség. A SE felvételeken az erek, főleg az artériák, az
áramlás hatására sötéten ábrázolódnak. Az ún. áramlási jelkiesés hiánya
biztos jele a trombózisnak, vagy egyéb okból bekövetkezett érelzáródásnak.
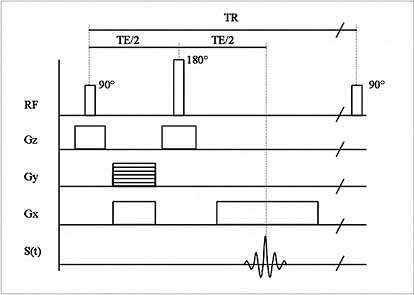
4. ábra. A spin-echó impulzus-szekvencia kottája. A 90 és 180
fokos RF impulzusnak és a három gradiens impulzusainak pontosan időzítve
kell lennie.
A gradiens-echó (GE) szekvencia abban különbözik a spin-echótól, hogy
a reszinkronizációt nem 180 fokos rádiófrekvenciás impulzus, hanem bipoláris
gradiens impulzus végzi. A GE szekvencia általában gyorsabb, mint a SE,
jellegzetessége, hogy az erek a mozgó vér miatt fehéren ábrázolódnak, és
a képek kontrasztját a szuszceptibilitási különbségek erősen befolyásolják.
Ez utóbbit kihasználva az ún. T2*-súlyozott (T2 csillag) szekvenciával
a kisebb vérzések már akut szakban is jól kimutathatók (Lifante, Llinas,
Caplan, Warach, 1994). Ugyanezen ok miatt a GE szekvencia igen közkedvelt,
például az ízületek vizsgálatában. Az ízületi szalagok és a rostos porc
inhomogén szerkezete miatt jelszegény, míg az üvegporc homogenitása miatt
jelgazdag. A rostos szerkezet sérülése jelfokozódást eredményez, az üvegporc
homogenitásában bekövetkező legkisebb változás pedig jól látható jelcsökkenést
okoz.
Az MR az ún. 3DFT technikával képes nagyon vékony, akár 0.5, sőt 0.1
mm vastag szeletkép sorozat készítésére, ami lehetőséget ad arra, hogy
bizonyos struktúráknak (pl.: agyfelszín, érrendszer) - a 3 dimenziós rekonstrukciós
módszerekkel - a térbeliségét is ábrázoljuk (Stark, 1999).
A 3DFT technikával, vékony, erősen T2-súlyozott felvételsorozattal
a folyadékterek MR vizsgálata valósítható meg (Pl.: MR-myelográfia, MR-ciszternográfia,
MR-cholangio-pancreatográfia (MRCP), MR-sialogram, stb.).
Az MR-angiográfia lehetőséget nyújt az erek nem invazív, illetve minimálisan
invazív vizsgálatára. Az MR-angiográfia a DSA felvételekhez hasonló szummációs
jellegű képeket készít, amivel az érszerkezet jól megítélhető (5. ábra).
Az MR-angiográfia az MR ún. áramlási jelenségeit használja fel a mozgó
vér detektálására. A legegyszerűbb és leggyakrabban használt módszer az
ún. TOF (time-of-flight) MR-angiográfia (Atlas, 1994; Atkinson, Brant-Zaqadzki,
Gillan, et al., 1994). Ha kifejezetten az áramlás kimutatása, vagy kvantifikálása
a cél, akkor ún. fáziskontraszt (PC) MR-angiográfiát végzünk (Dumoulin,
Souza, Walker, Wagle, 1989). A perifériás illetve nagyerek vizsgálatára
intravénás bolusban beadott kontrasztanyag segítségével, az ún. kontrasztos
(contrast enhanced, CE) MR-angiográfiára is van lehetőség.
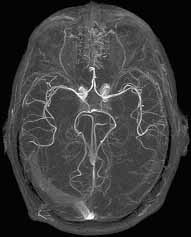
5. ábra. Az agy ereiről készült MR-angiográfia.
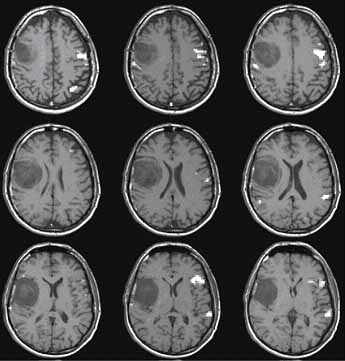
A diffúziós MR sok érdekes lehetőséget biztosít a szövetek biofizikai tulajdonságainak megítélésére, ami nagyon jól korrelál például a viabilitással (Le Bihan, Breton, Lallemand, et al., 1986). Az ún. diffúzió-súlyozott MR felvétel a hyperacut ischemiás stroke kimutatásának legérzékenyebb módszere (Kennedy, Buchan, 2004) (6. ábra). Ebben a szekvenciában az ún. diffúziós gradiens impulzusok miatt az extracelluláris víz diffúziós mozgásának megfelelően jelcsökkenés lép fel. A normál diffúzió cytotoxikus ödéma esetén a sejtduzzadás miatt jelentősen gátolttá válik, ami a jelcsökkenést enyhíti, így ez a terület relatíve magas jelintenzitású lesz.
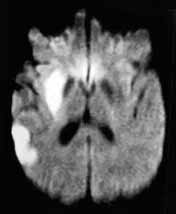
6. ábra. A diffúzió-súlyozott felvételen jobb oldalon két acut
ischemias terület látható.
A diffúzió-súlyozás mértékét a gradiens impulzusoktól függő ún.
’b’ érték határozza meg. A ’b’ szokásos értékei: 0, 500, 1000, 5000, de
erre alkalmas berendezésnél 10-20 ezer is lehet. Az extrém nagy ’b’ értékek
esetében a diffúzió-súlyozott MR felvételek a szövetekben a különböző víz
kompartmenek vizsgálatát teszi lehetővé (Cohen, Assaf, 2002). Több ’b’
értékkel készült felvételből a diffúziós koefficiens (ADC) voxelről-voxelre
kiszámítható. Az így készült, kalkulált kép az ún. ADC map, melyen az egyes
területek diffúziós képességének kvantitatív elemzése is lehetséges.
A perfúziós MR segítségével a parenchymás szervek szöveti vérátáramlása
vizsgálható. A különféle perfúziós paraméterek (time to peak, mean transit
time, regional cerebral blood flow) voxelről-voxelre történő kiszámításával
készülő kalkulált képek nagyon jól ábrázolják a rosszul perfundált területeket,
ami a nagy rizikójú régiót határolja körül, vagy ellenkezőleg, a hyperperfundált
terület malignus elváltozásra utalhat.
A dinamikus MR lényege a kóros szövetek, tumorok kontrasztanyag-halmozásának
időbeli vizsgálata. A dinamikus MR vizsgálat során a bolusban adott intravénás
kontrasztanyag után 20-30 másodpercenként készítünk képeket. A felvételeken
a különböző szövetek eltérő kontrasztanyag-halmozási dinamikája lesz megfigyelhető,
illetve mérhető, és grafikusan ábrázolható.
Az ízületek, a gerinc és a szív mozgását követő, filmszerűen lejátszható
felvételsorozat a kinematikus MR, melyen az ízületek inkongruenciája, az
ízületi szalagok elégtelensége, vagy az esetleges gerinc instabilitás ítélhető
meg (Patel, Hall, Ries, Lotz, et al., 2004; Muhle, Resnick, Ahn, 2001).
7. ábra. Funkcionális, beszédaktivációs MR felvétel. Jobb oldali
temporalis tumor, bal oldali dominanciájú beszédközpont.
Az MR a test anatómiai szerkezetének pontos leírása mellett több funkcionális
információt is képes szolgáltatni. Ilyenek a véráramlással, diffúzióval,
kontrasztanyag halmozással, bizonyos anyagcsere-folyamatokkal kapcsolatos
adatok. Az agy vizsgálatánál az MR lehetőséget biztosít arra is, hogy a
működésével összefüggő neuronális aktivitást kimutassuk, és pontosan lokalizáljuk.
Ezt a feladatot az ún. funkcionális MR (fMRI) látja el (Jezzard, Matthews,
Smith, 2001). A neuronális aktivitás az MR-rel közvetett módon, az agyi
erek autoregulációjának követésével érhető el. Erre a feladatra korábban
többféle technikai próbálkozás történt, de a legmegfelelőbbnek az ún. BOLD
(blood oxygenation level-dependent) technika mutatkozott (Ogawa, Menon,
Tank, 1993). Ennek lényege az, hogy a neuronális aktivitás okozta értágulat
az adott régióban lényegesen csökkenti a paramágneses tulajdonságú deoxihemoglobin
szintet, ami a T2*-súlyozott felvételeken lokális jelszint emelkedést vált
ki. A jelemelkedés nem jelentős, csupán 1-2%, de a többször ismételt nyugalmi
és aktivizált mérések képeinek voxelről-voxelre történő statisztikai elemzése
kirajzolja azt a területet, ahol az aktivitás szignifikáns jelváltozást
okozott. (7. ábra).
Az NMR felfedezésével az anyagszerkezet, így a biológiai anyagok vizsgálatában
is hatalmas jelentőségű spektroszkópiás módszer született. Az MR berendezés
segítségével ugyancsak elvégezhetők ezek a spektroszkópiás elemzések, ráadásul
nem szükséges az anyag kivétele (biopszia), elegendő az MR képen az érdekelt
térfogatot megjelölni. Általában a legkisebb vizsgálható térfogat 1 cm3
szokott lenni. A spektroszkópiás vizsgálattal a szövetekre jellemző aminosavak,
vagy egyéb szerves molekulák kimutathatók, ezek relatív mennyisége is meghatározható.
Ezeknek az anyagoknak a változása, vagy kóros anyagok megjelenése a spektrogramon
különféle betegségekre jellemző lehet, így az MR spektroszkópia a minőségi
diagnózis felállítását segítheti elő (Frahm, Bruhn, Gyngell, 1989; Salibi
N, Brown, 1997).
A mai MR berendezések a spektroszkópiás elemzést egy meghatározott
területen pontról-pontra el tudják végezni, és az eredményt színkódolt
szeletkép formájában képesek ábrázolni (spectroscopic imaging) (Fulham,
Bizzi, Dietz, et al., 1992).
Kontrasztanyagok
Az MR felvételek jeltartalma különféle kontrasztanyag használatával
befolyásolható. A kontrasztanyag feladata, hogy a kóros folyamatok kimutathatóságát
növelje. Ehhez az szükséges, hogy megváltoztassa valamelyik, a képalkotásban
felhasznált MR paramétert, ezért a kontrasztanyagok általában mágneses
tulajdonságúak. Természetesen lényeges szempont, hogy a kontrasztanyagot
valamely szövet vagy folyamat halmozza, továbbá, hogy a kontrasztanyagnak
alacsony legyen a toxicitása, legyen stabil vegyület, és teljes ürüljön
ki a szervezetből.
A kontrasztanyagot intravénásan vagy szájon át alkalmazhatjuk. Az MR
paraméterek közül a legegyszerűbb a protondenzitást növelni, erre a célra
legalkalmasabb a víz, amit például a belek feltöltésére szoktak alkalmazni.
A mágneses tulajdonság alapján a kontrasztanyag lehet paramágneses és ferromágneses.
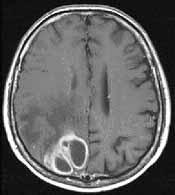
8. ábra. Agytályog Gd-DTPA halmozású, T1-súlyozott felvétele
A ma forgalomban levő paramágneses kontrasztanyagok makromolekulákhoz
kötött gadolínium (Gd) tartalmú kelátok (az első, kereskedelmi forgalomban
kapható kontrasztanyag a Gd-DTPA) (Weinmann, Brasch, Press, Wesbey, 1984).
A leggyakrabban használt Gd tartalmú paramágneses kontrasztanyagot intravénásan
alkalmazzuk. A kontrasztanyag a vérrel a szövetekhez jut, ahol a vaszkularizáció,
az intersticiális folyadéktér nagysága, a központi idegrendszer esetén
a vér-agy gát sérülése és esetleges aktív folyamatok befolyásolják a halmozódását.
Az intravénásan alkalmazott paramágneses kontrasztanyag a halmozódás helyén
jelentősen rövidíti a T1 relaxációs időt, ezért kontrasztanyag adása után
T1-súlyozott felvételeket készítünk, ahol a halmozás helyén a kép világosabb
lesz, megnövelve az adott szövet kontrasztját a környezetéhez képest (8.
ábra).
A super-paramágneses kontrasztanyag, ultra-kis méretű vasoxid szemcsék
(nanopartikulák) vizes keveréke, ami általában phagocytosis útján halmozódik.
A kontrasztanyag partikuláris szerkezete miatt nagy mágneses inhomogenitást
okoz a halmozás helyén, ami elsősorban a T2 súlyozott felvételeken nagy
jelveszteséget okoz. A kontrasztanyag nagyon alkalmas a nyirokcsomók, a
máj és a lép vizsgálatára (Kopp, Laniado, Dammann, et al. 1997).
Biztonsági szempontok
Az MR berendezés a nagy mágnes miatt nagyon balesetveszélyes. A mágnes
ferromágneses tárgyakat magához ránt, ami lövedék sebességre gyorsulhat,
így életveszélyt jelenthet a beteg és a személyzet számára, valamint jelentős
anyagi kárt okozhat a berendezésben. Emiatt a biztonsági rendszabályok
betartása különösen fontos (Chu, Sangster, 1986).
Mai tudásunk szerint a vizsgálat során alkalmazott nagy sztatikus mágneses
térnek (0.2 - 2 Tesla) és a rádiófrekvenciás sugárzásnak nincs káros biológiai
hatása (Gangarosa, Minnis, Nobbe, Praschan, Genberg, 1987). Az MR vizsgálat
kontraindikációi részben a nagy mágnessel, részben a szűk és meglehetősen
zárt vizsgálótérrel függenek össze: abszolút kontraindikációt jelent a
szívritmus-szabályozó és az artériás clip, mivel ezek a mágneses térben
életveszélyt jelentenek. Fémprotézisek, fém idegentestek az adott régióban
értékelhetetlenné tehetik a felvételeket, ez relatív kontraindikációt jelent.
A vizsgálatot meghiúsíthatja a beteg klausztrofóbiája, valamint nyugtalansága.
A nem kooperáló, nyugtalan betegek, vagy a csecsemők és kisgyermekek altatása
a szűk tér miatt nem könnyű feladat, de MR-kompatibilis monitorozás segítségével
a súlyos állapotú betegek is biztonságosan vizsgálhatók.
Az MRI alkalmazása a sugárterápiában
A célterület
Az MRI orvosi alkalmazásának speciális esete a sugárterápia. A sugárterápiában
használt leképezési eljárások célja, hogy olyan torzításmentes - ma már
3D kép - álljon rendelkezésünkre, amelyen meg tudunk határozni néhány fontosabb
térfogatot (9. ábra), amit a megfelelő sugárzással kezelni fogunk (ICRU
1993, ICRU 1997). A besugárzás-tervezéshez természetesen ismerni kell az
elektronsűrűséget is.
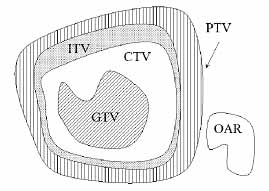
9. ábra. A célterület fogalma a sugárterápiában.
A Gross Tumor Volume (GTV) lényegében a rosszindulatú elváltozásnak
észlelhető részeit tartalmazza (beleértve a metasztatikus limfadenopátiákat
és a metasztázisokat is). A daganatsejtek sűrűsége általában ezekben a
térfogatokban a legmagasabb, eléri a 1010 sejt/cm3 értéket . A GTV nagymértékben
függ az alkalmazott vizsgálati eljárástól és leképezési technikától, de
szubjektív elemeket is tartalmaz. A Clinical Target Volume (CTV), magában
foglalja a GTV-t és/vagy olyan szubklinikus rosszindulatú elváltozást,
amit el kell pusztítani. Ennek megfelelően a CTV-ben a daganatsejtek sűrűsége
108 sejt/cm3 érték alatt van. Mindkettő klinikai-anatómiai fogalom. Ha
nem tudjuk az egész GTV-t a kívánt dózissal kezelni, akkor nem kuratív,
hanem csak palliatív kezelést végzünk.
A CTV-hez még hozzáadunk egy biztonsági zónát (ezzel vesszük figyelembe
a fiziológiás elmozdulásokat, térfogat, hely és alakváltozásokat) és az
egészet Internal Target Volume-nak (ITV) nevezzük. A Planning Target Volume
(PTV) az ITV-nél nagyobb, mert a beállítási és dozimetriai pontatlanságokat
is magában foglalja. OAR (Organs at Risk) a védendő területet jelöli.
A céltérfogat helyes megadásának problémáját jól mutatja a 10. ábra.
A sematikus ábra két agydaganatos beteg oldalirányú felvétele alapján készült.
Ezekkel demonstrálta Wambersie az ICRU elnöke a modern leképezési eljárások
nélkül végzett tumor-meghatározás (GTV) szubjektív voltát (Wambersie, 1999
és ICRU 1999). A folytonos vonalak 8 sugárterapeuta, a szaggatott és pontozott
vonalakat pedig 2-2 radiológus, ill. idegsebész véleménye.
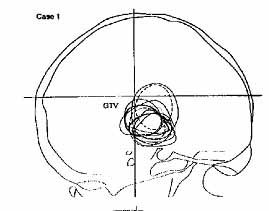
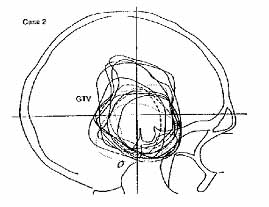
10. ábra. A célterület kijelölése röntgen felvétel alapján
A sugárterápia alapja tulajdonképpen két feltétel egyidejű optimálásán
alapszik: minél nagyobb valószínűséggel el kell pusztítani a kóros szövetet
úgy, hogy eközben az ép területek - különösképpen az ún. védendő képletek
- károsodásának minél kisebb valószínűsége legyen. Erre természetesen csak
akkor van reményünk, ha a kóros területet meg tudjuk határozni. Az ábrából
egyértelmű, hogy ez bizonyos körülmények között nem sikerül.
A sugárterápiában használt leképező eljárások
A besugárzás-tervezésben kiemelkedő fontossága van a CT-nek és az MRI-nek.
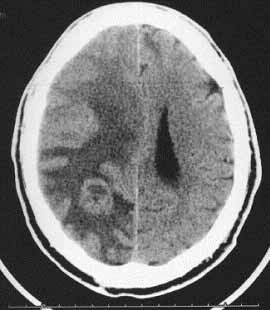
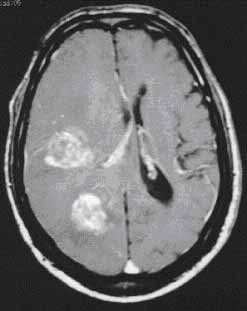
11. ábra. Ugyanannak a betegnek a koponya keresztmetszete CT-vel (balra)
és MRI-vel (jobb oldalon)
A 11. ábra jól mutatja az MRI jelentőségét. A CT metszeten csak egy szoliter metasztázis, valamint ödéma és kamraelzáródás látható. A gadolíniummal végzett MRI azonban további metasztázisokat mutat ki. Nem mutatjuk azt az ábrát, amelyen ebben a betegben – más felvételi paraméterek mellett még egy harmadik metasztázis is kimutathatóvá válik (Kagan, 1997).
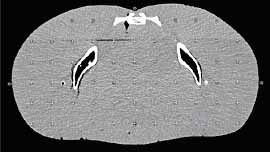
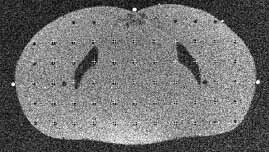
12.ábra. Alderson-Rando fantom leképezése (CT, bal oldal) és torzulása
(MRI, jobb oldal)
A 12. ábra az MRI legfontosabb hátrányait jelzi. Az ábrán Alderson Rando
fantom szagittális metszete látható (Major, 2002). Ez a fantom megfelelően
preparált emberi csontokat tartalmaz, és ezt öntik ki a szövet-ekvivalens
masszával. Ezen a képen is jól látható az izocentrumtól távolodva a torzítás
növekedése. A doziméterek elhelyezésére szolgáló furatokat 3 cm-es mátrixban
helyezték el. Az MRI-n a csont nem ad jelet. A medence fantom koronális
metszetén a z irányú torzítás párnásodásként jelentkezik.
Az MR képek torzítása kis térfogat esetében (15 ´15 ´ 20 cm3, pl. koponya,
fej-nyak, pl. 22, 29) általában nem haladja meg a 2-3 mm-t. A torzítás
mértéke azonban a mágneses izocentrumtól távolodva egyre nőni fog, és kismedence
esetében akár a 10-15 millimétert is elérheti (Fransson, Andreo és Pötter,
2001).
Ma már számos ún. 3D besugárzás-tervező rendszer kapható. Régebben
ezeket a programokat sokszor magunk fejlesztettük. A programok általános
jellemzője, hogy csak axiális CT keresztmetszeteket fogadnak el (ezekből
készítik az ún. DRR, digitally reconstructed radiograph) képeket. A CT
képeken az azonos szövetek jó közelítéssel azonos jelet adnak, így megfelelő
(Hunsfield) egységekben adhatjuk meg ezeket. A CT képekből kalibrációs
görbe segítségével megkaphatjuk az egyes pixelekhez tartozó elektronsűrűségeket.
Ezek a besugárzás-tervezéshez nélkülözhetetlenek. A külső sugárterápiában
használt legfontosabb sugárkvalitások 1 – 10 MeV fotonenergia között vannak.
Az MR esetében számos lehetőséggel rendelkezünk. A jelintenzitás elsősorban
a protonsűrűségtől és a T1 és T2 relaxációs időktől függ. Az orvos a vizsgálatokhoz
igen sok féle szekvenciát alkalmaz. Vagyis nem áll olyan standard módszer
rendelkezésünkre, amivel az egyes szervekhez a jelintenzitás alapján a
CT-hez hasonlóan sűrűséget tudnánk rendelni.
Mindkét eljárásnál gondot okoz a beteg rögzítése, mert az csak korlátozottan
kivitelezhető. Az axiális térbeli felbontás mindkét eljárásnál < 1 mm.
A vizsgálati idő a CT esetében rövid, az MRI-nél viszont hosszú. A vizsgálati
idő növekedésével a beteg és a betegben az egyes szervek elmozdulásának
valószínűsége nő. A táblázat nem tartalmazza a vizsgálandó objektum összetételével
kapcsolatos torzulást (kémiai eltolódás). A táblázat – a vizsgálat árától
függetlenül is - jelzi, hogy a besugárzás-tervezéshez közvetlenül továbbra
is a CT-t fogjuk használni, de számos esetben az MRI nélkülözhetetlen a
célterület pontos kijelölésében.
Első lépésként a CT kép pontjait többé-kevésbé kölcsönösen és egyértelműen
meg kell feleltetnünk az MRI képeknek. Ezt a tevékenységet szokás képregisztrációnak
nevezni. Ennek legegyszerűbb formája a párhuzamos megtekintésen alapuló
összehasonlítás, amikor a két képsorozatot egymás mellett vizsgáljuk (filmen,
vagy képernyőn), és megfigyelés alapján viszünk át információkat az egyikről
a másikra. Ez eléggé szubjektív és nagyon pontatlan módszer, mert sokszor
még a CT és MRI sem síkok feleltethetők meg kölcsönösen egymásnak.
MRI adatátviteli módszerek a CT képre: a két kép egyidejű megtekintése,
majd
· bizonyos képletek, ismertető jelek alapján (landmark), melyeket mindkét
képen 2D-ben meg kell adni, vagy
· anatómiai kontúrok
alapján illesztjük a két képet. Lehet még a képek váltakozó megjelenítésével,
interaktív módon is illeszteni a képeket. Mindkét módszer időt rabló.
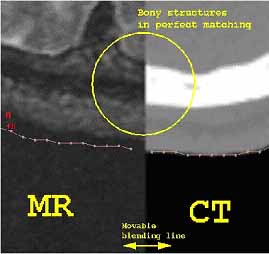
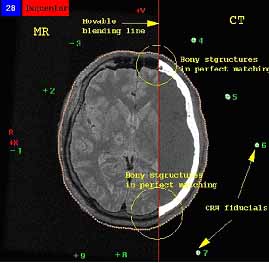
13. ábra. CT és MR képek kézi illesztése.
Külső jelöléseket is alkalmazhatunk, ha azok rendelkezésre állnak. Erre
a célra jól használható az E vitamin kapszula. Kontrollvizsgálatoknál ez
gyakorlatilag nem lehetséges. Gondot jelent az is, hogy nagyobb méretek
(pl. medence) esetében az MR éppen a szélen torzít. Regisztrációnak szokták
nevezni azt a tevékenységet, aminek eredményeképpen a kijelölt (ún. fiduciális)
pontokat vagy szerv kontúrokat a két képen megfelelő transzformációkkal
egymáshoz illesztjük. Legegyszerűbben kézi, interaktív módszerrel tudjuk
az egyik adathalmazt síkbeli eltolásokkal és forgatásokkal fedésbe hozni
a másikkal. Ebben a fiduciális pontok (pl. koponya-besugárzások esetében
a rögzítő keret metszetei) nagy segítséget jelentenek (13. ábra) (Fichtinger
G., O’Malley S., Wu Terry, Harisiadis L. és Wessels B.W., 1998).
Számítógépes programokkal természetesen sokkal pontosabb és gyorsabb
megfeleltetés (regisztráció) érhető el. Ezek a programok általában azt
feltételezik, hogy mindkét leképezéssel kapott mátrix szilárd testként
viselkedik, és valamennyi pontra ugyanaz a transzformáció érvényes (van
Herk és Kooy, 1994; Khoo, Dearnaley, Finnigan, Paghani, Tanner és Leach,
1998; Fransson, Andreo és Pötter, 2001):
r1 = A × r2 + b
ahol r a megfelelő pontok koordinátáit jelöli, A a nyújtást és a forgatást magában foglaló mátrix, b pedig az eltolás vektor. A néhány pont felhasználásával végzett számítógépes illesztés ma már a kereskedelemben kapható besugárzás-tervező programoknak is (általában) opcionális tartozéka. A számunkra rendelkezésre álló két tervező programban (CadPlanä, Varian, illetve XiOä, CMS) a CT képek kontúrozása, azaz a célterület és a szervek kijelölése történhet a besugárzás-tervező munkaállomáson is, de célszerű ezeket az elsősorban kontúrozási célt szolgáló számítógépeken (SomaVisionä, Varian, ill. Focalä, CMS) végezni. A képregisztrálás viszont csak ezeken az utóbbi gépeken lehetséges. A regisztrálás néhány pont felhasználásával történik. Térbeli illesztéshez minimálisan 4 pont szükséges. Ilyen regisztrálást mutat a 14. ábra (Parker és Patrocinio, 2003).
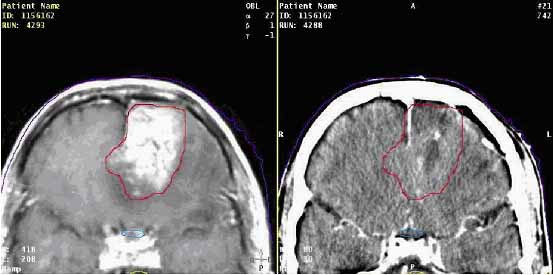
14. ábra MRI (bal oldal) alapján meghatározott CTV átvitele a CT képre
(jobb oldal)
A kézi regisztrálás teljesen automatizált változata lényegében „sablon”
alkalmazásával történik. Mindkét képből (ez esetünkben CT és MR) megfelelő
görbéket kell extrahálni. A görbék keresése megfelelő ablaktechnikával
végezhető, a számos, csak néhány pontot tartalmazó kis képletet kizárjuk
(van Herk és Kooy, 1994).
Az illesztendő képen a megfelelő vonalakat fel kell darabolni, majd
ezeket a sablonhoz illesztjük. Lényeges, hogy ne legyen túl sok pont, mert
ez nagyon megnöveli a számítási időt. Referenciának általánosságban a megfelelő
pontosságú CT felvételeket tekintjük, és ehhez a felülethez illeszti a
program a szegmentált MR görbéket. Általában néhány ezer pontnál többet
nem használnak, és az iteráció legfeljebb néhány száz lépésből áll.
Számítógépes eljárással olyan transzformációt keresnek, ami a két képet
egymáshoz megfelelően illeszti. Általában itt is eltolásról, forgatásról
és lépték változatásról (scaling) van szó. Esetenként egy további transzformációval
kis mértékben az Y és a Z tengely megnyúlását lehet még korrigálni.
Az illesztés jóságát kifejező függvényként vagy a jól ismert átlagos
eltérést és/vagy a szórás térbeli változatát használják:
C(T) = sqr{SF2[Tri]/(N-1)}
C(T) =SF[Tri]/(N-1)
Mindkét esetben i-re kell összegezni, és F(Tr) az illesztett pont transzformáltjának
a sablontól való távolságára utal.
Az MRI megbízható és ideális arra, hogy a besugárzás-tervezés kiegészítője
legyen. Az MRI feloldása jobb, mint a CT-é a központi idegrendszer, lágy
szövetek és a fej-nyak tájék esetén. Mellkasi elváltozások esetében a tumor
és hiláris nodusok kimutatására jobb, mint a CT, de hasznos a bél, a genitáliák,
és a nőgyógyászati tumorok diagnosztikájában is. Vagyis az MRI-t nem tekinthetjük
a besugárzás-tervezésre önmagában is megfelelő, a CT alapú tervezés alapvető
jellegét veszélyeztető képalkotó eljárásnak, mert (i) az elektronsűrűségre
nem ad adatokat, a (ii) kortikális csontokat nem ábrázolja, (iii) intrinsic
geometriai hibák terhelik, és (iv) nem-nagyon van olyan besugárzás-tervező
program, ami az MRI képeket megfelelően integrálja, és így azokat megfelelően
kezelhetővé teszi.
Irodalom
Atkinson D, Brant-Zaqadzki MN, Gillan GD, et al.: Improved MR angiography:
magnetization transfer suppression with variable flip angle excitation
and increased resolution. Radiology 1994; 190:890.
Atlas SW: MR angiography in neurologic disease. Radiology 1994; 193:
1.
Atlas SW: MRI of the Brain and Spine. Lippincott Williams & Wilkins,
2003.
Chu WK, Sangster W: Potential impacts of MRI accidents. Radiol Technol.
1986; 58(2): 139-41.
Cohen Y, Assaf Y: High b-value q-space analyzed diffusion-weighted
MRS and MRI in neuronal tissues - a technical review. NMR Biomed. 2002;
15(7-8): 516-42.
Dumoulin CL, Souza SP, Walker MF, Wagle W: Three-dimensional phase
contrast angiography. Magn Reson Med 1989; 9: 139-149.
Fichtinger G, O’Malley S, Wu T, Harisiadis L, Wessels BW: :3D image
volume fusion for stereotactic radiosurgery and neurosurgery. Radiológiai
Közlemények 34 (Suppl. 1) (1998) p. 65.
Frahm J, Bruhn H, Gyngell ML: Localized high resolution proton NMR
spectroscopy using stimulated echoes: initial applications to human brain
in vivo. Magn Reson Med 1989; 9: 79.
Fransson Annette, Andreo P, Pötter R: Aspects of MR image distortions
in radiotherapy treatment planning. Strahlenther. Onkol. 177 (2001) p.
59.
Fulham MJ, Bizzi A, Dietz MJ, Shih HH, Raman R, Sobering GS, Frank
JA, Dwyer AJ, Alger JR, Di Chiro G: Mapping of brain tumor metabolites
with proton MR spectroscopic imaging: clinical relevance. Radiology 1992;
185: 675-86.
Gangarosa RE, Minnis JE, Nobbe J, Praschan D, Genberg RW. Operational
safety issues in MRI. Magn Reson Imaging. 1987; 5(4): 287-92.
ICRU, International Commission on Radiation Units and Measurements:
Prescribing, recording and reporting photon beam therapy Report ICRU 50.
Bethesda, MD. 1993. ICRU. pp. 72.
ICRU, International Commission on Radiation Units and Measurements:
Dose and Volume Specification for Reporting Interstitial Therapy. Report
ICRU 58:Bethesda, MD. 1997. ICRU. pp. 35.
ICRU, International Commission on Radiation Units and Measurements:
Prescribing, Recording, and Reporting Photon Beam Therapy (Supplement to
ICRU Report 50). ICRU Report 62. Bethesda, MD. 1999. ICRU. pp. 53.
Jezzard P, Matthews PM, Smith SM: Functional MRI. An Introduction to
Methods. Oxford University Press, 2001.
Kagan RA: Palliation of Brain and Spinal Cord Metastases. In: Perez
CA, Brady LW (szerk.) Principles and Practice of Radiation Oncology. Third
Ed. New York. 1997. Lippincott-Raven. p. 2187-2197.
Kennedy J, Buchan AM: Acute neurovascular syndromes: hurry up, please,
it's time. Stroke. 2004; 35(2): 360-2.
Khoo VS, Dearnaley DP, Finnigan DJ, Paghani A, Tanner SF, Leach MO:
Magnetic resonance imaging (MRI): considerations and applications in radiotherapy
treatment planning. Radiother. Oncol. 42 (1997) p. 1.
Kopp AF, Laniado M, Dammann F, Stern W, Gronewaller E, Balzer T, Schimpfky
C, Claussen CD: MR imaging of the liver with Resovist: safety, efficacy,
and pharmacodynamic properties. Radiology. 1997; 204(3): 749-56.
Le Bihan D, Breton E, Lallemand D, et al.: MR imaging of intravoxel
incoherent motions: Application to diffusion and perfusion in neurologic
disorders. Radiology 1986; 161: 401-407.
Linfante I, Llinas RH, Caplan LR, Warach S: MRI features of intracerebral
hemorrhage within 2 hours from symptom onset. Stroke. 1999; 30(11): 2263-7.
Major, T: MRI képek besugárzás-tervezéshez történő használhatóságának
vizsgálata. In: Proc. IX. Hungarian Medical Physics Conference. Eger. 2002.
Radó Nyomda, ISBN 9632063511 p. 33-38.
Muhle C, Resnick D, Ahn JM, Sudmeyer M, Heller M: In vivo changes in
the neuroforaminal size at flexion-extension and axial rotation of the
cervical spine in healthy persons examined using kinematic magnetic resonance
imaging. Spine. 2001; 26(13): E287-93.
Ogawa S, Menon RS, Tank DW, Kim SG, Merkle H, Ellermann JM, Ugurbil
K: Functional brain mapping by blood oxygenation level-dependent contrast
magnetic resonance imaging. A comparison of signal characteristics with
a biophysical model. Biophys J. 1993; 64(3): 803-12.
Parker W, Patrocinio H: Clinical Treatment Planning in External Radiotherapy
. In Podgorsak EB (szerk.): Review of Radiation Oncology Physics: A Handbook
for Teachers and Students Vienna. 2003. International Atomic Energy
Agency, p. 179-224.
Patel VV, Hall K, Ries M, Lotz J, Ozhinsky E, Lindsey C, Lu Y, Majumdar
S: A three-dimensional MRI analysis of knee kinematics. J Orthop Res. 2004;
22(2): 283-92.
Salibi N, Brown MA: Clinical MR Spectroscopy: First Principles. Wiley,
1997.
Stark DD, Bradley WG, Jr.: Magnetic Resonance Imaging. Mosby, 1999.
van Herk M, Kooy HM: Automatic three-dimensional correlation of CT-CT,
CT-MRI, and CT-SPECT using chamfer matching. Med. Phys. 21(1994) p. 1163.
Wambersie, A: Margins in external beam therapy: the new ICRU recommendations
(Supplement to ICRU Report 50). ). Radiológiai Közlemények 35 (Suppl. 1)
(1999) 60-81
Weinmann HJ, Brasch RC, Press WR, Wesbey GE: Characteristics of gadolinium-DTPA
complex: a potential NMR contrast agent. AJR Am J Roentgenol. 1984; 142(3):
619-24.