Peptid-foldamerek „gépi kódja”: de novo hélixtervezés sztereokémiai mintázatokkal
Martinek Tamás, Fülöp Ferenc
Szegedi Tudományegyetem, Gyógyszerkémiai Intézet, Szeged, Eötvös u. 6.
A foldamerek önrendeződési folyamatainak irányítása jelentős kihívást jelent és nagy érdeklődésre tart számot, mivel az eredményül kapott biomimetikus szerkezeteknek többféle alkalmazásuk lehet a bioaktív anyagoktól a nanostruktúrák létrehozásáig. Az önrendeződő, ?-aminosavakat tartalmazó peptidek a leginkább vizsgált molekulák közé tartoznak, mert számos másodlagos szerkezeti típust képesek szabályozható módon létrehozni.1-4
A fő célkitűzésünk az volt, hogy egy általános összefüggést találjunk a lánc sztereokémiai mintázata és az indukált másodlagos szerkezet között. Ehhez definiáltunk egy kontextus-független bináris leíró paramétert az önrendeződésért felelős királis építőelemekre, majd megvizsgáltuk a deszkriptor mintázatait a már ismert másodlagos szerkezeteken. A felismert szabályszerűségek segítségével de novo terveztünk és szintetizáltunk helikális foldamer szekvenciákat. Az oligomereket molekula modellezés, NMR spektroszkópia és cirkuláris dikroizmus spektroszkópia segítségével jellemeztük. Eredményeink szerint a bináris deszkriptor és a szabályok predikciós ereje megfelelő; a szabályoknak megfelelően tervezett oligomerek az irodalomban eddig nem ismert hélixeket formáltak, míg a kontroll szekvenciák nem mutattak periodikus másodlagos szerkezetet.
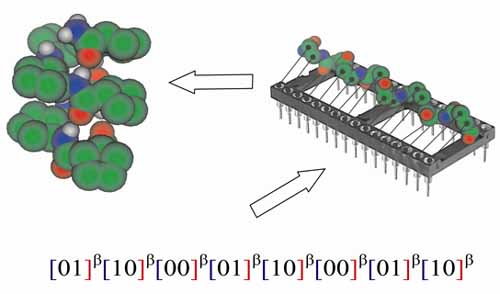
Ezek a megfigyelések egy érdekes analógiát vetnek fel. A bináris sztereokémiai deszkriptorok szekvenciája programként hajtódik végre a peptid gerincen mint analóg számítógépen, ahol a kimenet a másodlagos szerkezet.
1. T. A. Martinek, G. K. Tóth, E. Vass, M. Hollósi, F. Fülöp, cis-2-Aminocyclopentanecarboxylic
acid oligomers adopt a sheetlike structure: switch from helix to nonpolar
strand. Angew. Chem. Int. Ed., 41, 1718-1721 (2002)
2. A. Hetényi, I. M. Mándity, T. A. Martinek, G. K. Tóth, F. Fülöp,
Chain length-dependent helical motifs and self-association of ?-peptides
with constrained side-chains. J. Am. Chem. Soc. 127, 547-553
(2005)
3. T. A. Martinek, A. Hetényi, L. Fülöp, I. M. Mándity, G. K. Tóth,
I. Dékány, F. Fülöp, Residue-controlled intrinsic self-assembly of ?-peptides
into tertiary structure motifs. Angew. Chem. Int. Ed., 45, 2396-2400
(2006)
4. T. A. Martinek, I. M. Mándity, L. Fülöp, G. K. Tóth, E. Vass,
M. Hollósi, E. Forró, F. Fülöp, Effect of alternating back-bone configuration
on the secondary structure and self-assembly of b-peptides.
J. Am. Chem. Soc. 128, 13539-13544 (2006)