Felolvasóülés, 2011. december 13.
Somsák László
Debreceni Egyetem, Szerves
Kémiai Tanszék, somsak.laszlo@science.unideb.hu
Glikogén foszforiláz gátlás monoszacharid-származékokkal
Beszélgetés Somsák Lászlóval
Az előadás összefoglalójában szerepel, hogy a kémiai biológia fő törekvése a biológiai tér és a kémiai tér összeillő szegmenseinek megtalálása. Milyen elemekből áll össze ez a szemléletes kép?
A kémiai biológia most formálódó tudományterület; tömören úgy szoktak fogalmazni, hogy kémiai módszerek alkalmazása biológiai jelenségek felderítésére. Mára jelentős irodalma, több folyóirata is rendelkezésünkre áll. Természetesen igyekszik magát megkülönböztetni a biokémiától, a biológiai kémiától, a bioorganikus és a bioinorganikus kémiától, hiszen valóban arról van szó, hogy a kutatók a kémia eszköztárával próbálnak meg biológiai rendszereket vizsgálni. Erre elég sok lehetőség nyílik. Mi például kis, 500–1000 molekulatömegű molekulákat állítunk elő, ezekkel a biológiai rendszert „megzavarjuk”, majd kapunk valamilyen választ.
Mintha a perturbációszámítás kémiai analogonját valósítanák meg.
És ez a folyamat még beleillik a hagyományos biokémia körébe. De amikor a kismolekulát egy élő szervezetbe juttatjuk be, vagy sejtszinten kezdünk el vele vizsgálódni, az már kevésbé hagyományos. Egy sejt válasza valóban biológiai válasz.
A munkának van egyfajta körfolyamattal jellemezhető ciklusa. A ciklus indulhat a kismolekula szintézisével vagy például azzal, hogy felfedezünk egy biológiai jelenséget és azonosítunk egy fehérjét, ami ezért felelős. Ennek a ciklikus munkafolyamatnak a célja a kémiai és a biológiai tér megfeleltetése.
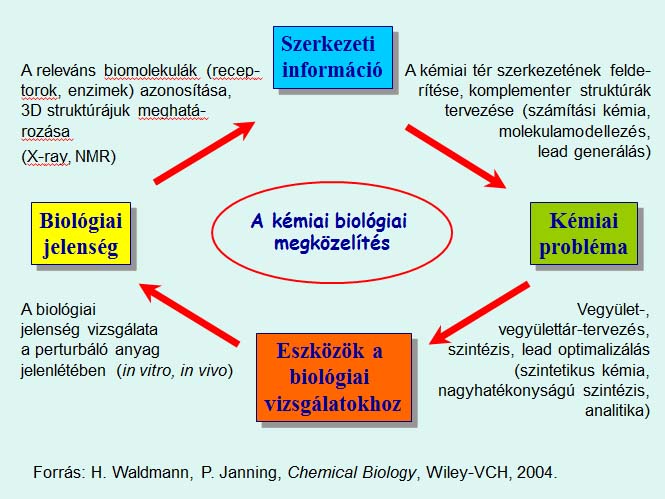
Azt kérdezte, hogy miből is állnak ezek a terek. Nézzük a biológiait. Ezt a fehérjék (vagy más biomakromolekulák) ligandumkötő helyei alkotják. Fehérjéből, például, legalább annyival kell számolnunk, mint a humán genomba tartozó gének száma (ennél sokkal több van az ún. poszttranszlációs módosítások, pl. acetilezés, metilezés, foszforilezés, szulfonilezés, glikozilezés következtében). Egy fehérjének lehetnek különböző kötőhelyei, és azt keressük, hogy melyek azok a szegmensei a biológiai térnek – melyek azok a kötőhelyek –, amelyek biológiailag értelmes vagy terápiásan hasznosítható választ adnak, ha kismolekulával megtámadjuk őket, azaz valamilyen ligandum megkötésének lehetőségét kínáljuk fel. A gyógyszerkutatók szerint a humán genom kb. 27 000 génjének várhatóan csak mintegy egytizedére lehetnek majd befolyással gyógyszerek. A jelenleg engedélyezett gyógyszerek kb. 170 biológiai makromolekulát vesznek célba, tehát a „gyógyszerelhető” biológiai tér még nagyrészt „terra incognita”.
A kémiai térbe beletartozik az összes, elektronok és atommagok által létrehozható, energetikailag stabilis elrendezés, vagyis a lehetséges molekulák összessége. Hadd hívjam fel a figyelmet egy érdekességre. Az engedélyezett gyógyszerek statisztikai elemzése alapján a kémiai térben a gyógyszerszerű molekulák száma mintegy 1060. (Az elemzésnek az az alapja, hogy az ún. Lipinski-szabályok szerint ezeknek a molekuláknak 500-nál kisebb a móltömegük, a hidrogénkötésre alkalmas donoratomok száma kisebb 5-nél, a hidrogénkötés-akceptorok száma kisebb 10-nél, az oktanol-víz (zsír-víz) megoszlási hányados kisebb 5-nél.)
1060 óriási szám!
Tegyük hozzá, hogy jelenleg a Chemical Abstracts adatbázisban nyilvántartott molekulák száma kb. 30 millió (3 × 107) – és már ez is igen nagy szám. Bizonyos megfontolások szerint az ismert Univerzumban nincs elég anyag ahhoz, hogy a 1060 szerkezet egy-egy molekuláját előállíthassuk!
Talán nincs is mindre szükség.
Visszatérve a kémiai biológiai megközelítéshez: induljunk ki most a biológiai jelenségből, ami – mondjuk – egy biológiai makromolekula működése. Ennek a molekulának remélhetőleg ismerjük a 3D szerkezetét, amit többnyire röntgen- vagy NMR-technikával határoznak meg. A szerkezetvizsgálat feltárja a molekula kötőhelyeit. A szintetikus kémikus pedig azt mondja, hogy ennek a biológiai térrésznek a kémiai megfelelőjét próbálom megkeresni: olyan molekulát próbálok készíteni, amelyik beleillik. A Fischer-féle kulcs-zár képpel élve, a kémikus kulcsokat keres ehhez a makromolekulához. Most már kémiai problémával állunk tehát szemben: molekulát kell tervezni, majd szintézist, azt meg is kell valósítani, szerkezetet kell bizonyítani stb. A biológus utána ezeket a vegyületeket mint eszközöket használja a biológiai jelenség vizsgálatára. Ekkor újabb biológiai válaszokat kap; megismeri, hogyan lehet a biológiai jelenséget befolyásolni, például serkenteni, gátolni, teljesen elnyomni – és a ciklus újra elindulhat. Ez a megközelítés célzott vizsgálatokat, fókuszált szintéziseket tesz lehetővé annak érdekében, hogy a 1060 szerkezetből a valóban hatásosak kerüljenek képbe.
Hogyan valósul meg a ciklus az Önök munkájában?
A májban levő glikogén foszforiláz a glikogén lebontásának sebességmeghatározó enzime –fontos szerepet játszik a vércukorszint beállításában. Az enzim inhibitorai potenciális diabétesz-gyógyszerek. Kémiai biológiai megközelítésünkben a lehető legjobb gátlószert szeretnénk megtalálni. A mi körfolyamatunkban a szerkezeti információ adott: ismerjük az enzim, a kötőhelyek szerkezetét.
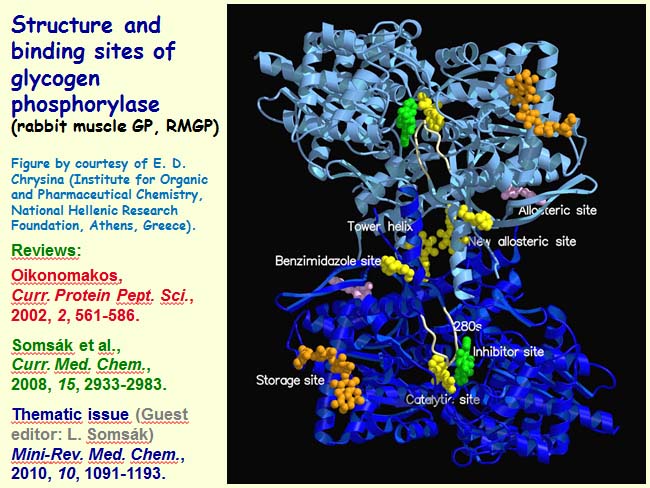
A glikogén foszforiláz szerkezete és kötőhelyei
Az előadás a kémiai probléma felvetésére és megoldására koncentrált: a molekulatervezésre, az ismert inhibitorok szerkezet-hatás összefüggéseken alapuló módosítására, a felmerülő szintetikus kérdések megoldására, a vegyületek szerkezetbizonyítására. Partnereink végezték el az enzimkinetikai és a röntgenkrisztallográfiai vizsgálatokat. Az előadás időtartama nem tette lehetővé, hogy említsem annak az együttműködő csoportnak a munkáját is, amely molekulamodellezési, kvantumkémiai számítási technikákat alkalmaz, hogy előre jelezzen várhatóan erősen kötődő, hatékony molekulaszerkezeteket. Ez a molekuláris vizsgálódás olyan ága, amely a költségeket igyekszik leszorítani, ugyanis olcsóbb lehet egy vegyületet a virtuális térben, in silico tanulmányozni, mint szintézissel előállítani és a biológiai rendszeren tesztelni.
Az előadásból kiderült, hogy még a szintézisben is együttműködnek francia partnerekkel. Nemrégiben találkoztam egy matematikussal, aki azt mondta, hogy nekik nagyon fontos a kollégákkal folytatott kötetlen beszélgetés. Egy elméleti fizikus pedig elmesélte, hogy az elektronikus kapcsolattartásnál sokkal hatékonyabb, ha ugyanabban a szobában futtatják a saját programjukat a saját laptopjukon, és megbeszélik az eredményeiket. Egy szintetikus vegyész leginkább a laborjában dolgozik – hogyan születik meg a közös eredmény?
Ugyanígy. Hiszen mindenkinek
más tapasztalatai vannak, más kollégákkal kerül kapcsolatba, más a mindennapi
környezete. A szerves szintéziseknek akkora az irodalma, hogy egyetlen
ember, de egyetlen csoport is képtelen mindent fejben tartani, megismerni.
Ezért kell minél többet beszélgetni – lehetőleg olyanokkal, akik hasonló
területen működnek, meg olyanokkal is, akik nagyon eltérő feladatokon dolgoznak:
megtermékenyíthetjük egymás gondolkozását.
Néhány további információforrás:
Somsák László, Bokor Éva,
Czifrák Katalin, Kónya Bálint, Kun Sándor, Tóth Marietta: A
glikogén foszforiláz glükózanalóg gátlószerei mint potenciális antidiabetikumok
(Magyar Kémiai Folyóirat, 2010, 116, 19–30.
Somsák László: Kémiai biológia
– avagy mit nyújt(hat) a kémia az élettudományoknak (A Magyar Tudomány
Ünnepe, 2007; az előadás diái)
László Somsák, Éva Bokor,
Katalin Czifrák, László Juhász, Marietta Tóth (2011), Carbohydrate Derivatives
and Glycomimetic Compounds in Established and Investigational Therapies
of Type 2 Diabetes Mellitus, Topics in the Prevention, Treatment and Complications
of Type 2 Diabetes, Mark B. Zimering (Ed.), ISBN: 978-953-307-590-7, InTech,
http://www.intechopen.com/articles/show/title/carbohydrate-derivatives-and-glycomimetic-compounds-in-established-and-investigational-therapies-of-
László Somsák, Glucose derived
inhibitors of glycogen phosphorylase (C. R. Chimie, 2011, 14, 211–223.)
László Somsák, Katalin Czifrák,
Marietta Tóth, Éva Bokor, Evangelia D. Chrysina, Kyra-Melinda Alexacou,
Joseph M. Hayes, CostasTiraidis, Eliada Lazoura, Demetres D. Leonidas,
Spyros E. Zographos, Nikos G. Oikonomakos, New Inhibitors of Glycogen Phosphorylase
as Potential Antidiabetic Agents (Current Medicinal Chemistry, 2008, 15,
2933–2983.)