Ligandum–fém kölcsönhatás tanulmányozása ultraibolya fotoelektron-spektroszkópiával néhány átmenetifém borohidrid- és ciklooktatetraén-komplexében
Eötvös Loránd Tudományegyetem, Budapest
2000
A fotoelektron-spektroszkópia nagyon hatékonyan használható a fémorganikus vegyületek elektronszerkezetének vizsgálatára. A módszer alkalmazásával információkat kaphatunk többek között a ligandum és a fématom elektronszerkezetérõl, a kötéseket kialakító pályák szimmetriájáról [1–6]. Jelen munka keretében átmenetifém-organikus vegyületek tér- és elektronszerkezetét vizsgáltam ultraibolya fotoelektron-spektroszkópia segítségével.
A vizsgált vegyültek két nagyobb csoportba oszthatók: egyrészt átmenetifém tetrahidridoborátok (CpZr(BH4)3, Cp2Zr(BH4)2, Cp2Ta(BH4), Cp2Hf(BH4)2, Cp2TaH3), másrészt az 1,3,5,7-ciklooktatetraén különbözõ átmenetifémekkel alkotott komplexei ((CO)3FeCOT, [(CO)3Fe]2COT, CpCrCOT, (CpCr)2COT, (CO)3CrCOT, (CO)3MoCOT, (CO)3WCOT, (CO)3MoCOTFe(CO)3).
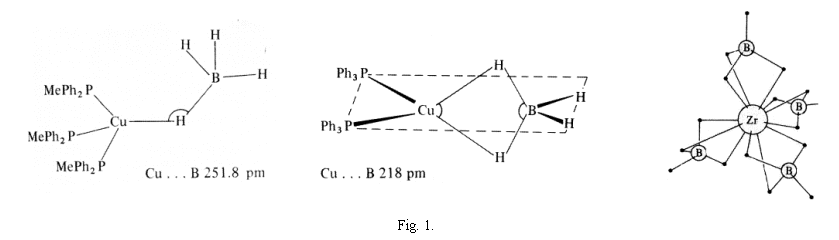
A borohidrid-komplexek térszerkezete, így elsõsorban a ligandumoknak a központi fématomhoz való kapcsolódási módja elméleti szempontból igen érdekes [7–10]. Ez a kapcsolat, mint ahogy az 1. ábrán is látható, egyaránt megvalósulhat egy, két, illetve három hidrogénhídon keresztül is. A komplexek szerkezetének meghatározásakor, amikor azt kell eldönteni, hogy az egyes borohidrid-csoportok egy-, két- vagy háromfogú ligandumként szerepelnek-e az illetõ molekulában, a legfõbb problémát az okozza, hogy diffrakciós módszerekkel a hidrogének nem „láthatók” A borohidrid-vegyületeknél elsõdleges célom a ligandumok és a központi fématom közötti kapcsolódás módjának vizsgálata volt.
A nyolctagú ciklooktatetraén-gyûrû nagy flexibilitásából adódóan különbözõ módon kapcsolódhat a központi fématomhoz. Komplexeiben különbözõ haptocitással fordulhat elõ, azaz a ligandum különbözõ számú szénatomon keresztül létesíthet kötést a központi fématommal. (2. ábra). A COT vegyületeiben hidat is alkothat, ilyenkor szin- és anti-konformációjú is lehet. A ciklooktatetraén-komplexek vizsgálatakor célul tûztem ki olyan vegyületek szintézisét, melyekben megnyilvánulhat a ligandum térbeli flexibilitása és ezzel összefüggõ elektronszerkezeti változatossága. A vizsgált vegyületek a gyûrû alakja, a központi fématomhoz kapcsolódó szénatomok száma (haptocitás) vagy a kapcsolódás módja szerint valamilyen logikai sorba illeszthetõk, megkönnyítve ezáltal a spektrumok értelmezését.
Eredmények
Borohidrid-komplexek
A vizsgált borohidrid-vegyületek fotoelektron-spektrumáról elmondható, hogy a d0 elektronszerkezetû komplexek (CpZr(BH4)3, Cp2Zr(BH4)2 és Cp2Hf(BH4)2) esetén a ciklopentadienil-gyûrû p-rendszerének ionizációja igényli a legkisebb energiát, az ennek megfelelõ sáv jelentkezik elsõként a spektrumban. A borohidrid-csoportot nem tartalmazó komplex (Cp2TaH3) színképébõl következtetni lehet arra, hogy a ciklopentadienil-gyûrû magasabb ionizációinak és a borohidrid ligandum ionizációinak energiaigénye közelítõleg azonos, ezért az ezeknek megfelelõ csúcsok összeolvadnak, ezek alkotják a CpZr(BH4)3, a Cp2Zr(BH4)2 és a Cp2Hf(BH4)2 színképében megfigyelhetõ második, átlapolt sávot. A d2 elektronszerkezetû komplex (Cp2Ta(BH4)) spektrumának szerkezete hasonló az elõzõekhez, azzal a különbséggel, hogy a színkép alacsony ionizációs energiájú tartományában megjelenik még egy sáv, mely a d-elektronok ionizációjához rendelhetõ.
A komplexek fotoelektron-spektrumának részletes vizsgálata alapján kimutatható, hogy a CpZr(BH4)3 esetében a borohidrid-csoport háromfogú, a Cp2Zr(BH4)2 és a Cp2Hf(BH4)2 esetében kétfogú ligandumként kapcsolódik a központi fématomhoz.
Ciklooktatetreaén-komplexek
A (CO)3FeCOT He(II) spektrumának segítségével megerõsítettem a vegyület már ismert He(I) színképének besorolását. Ennek nyomán kerülhetett sor a [(CO)3Fe]2COT vizsgálatára. Oldatfázisban a kétmagvú komplex két formában van jelen, melyek egymással egyensúlyban vannak (3. ábra) [11]. Az egyik speciesben fém–fém kötéssel kapcsolódik egymáshoz a két (CO)3Fe egység, míg a másikban ezek egymástól függetlenül találhatók. A fotoelektron-spektroszkópiai vizsgálatokból kitûnik, hogy gázfázisban, a mérés körülményei között (210 ºC-os hõmérséklet mellett) a jelen lévõ komponens nem tartalmaz fém–fém kötést, mindkét (CO)3Fe egységhez h4-kötéssel kapcsolódik a ciklooktatetraén ligandum. A kétmagvú komplex egyensúlya tehát teljesen eltolódik a fém–fém kötést nem tartalmazó speciesz képzõdésének irányába.
A CpCrCOT komplexben a ciklooktatetraén ligandum hat szénatomja kapcsolódik a központi fématomhoz. Ez az h6-os kapcsolódási mód benzolszerû kapcsolatra utal, ami azt jelenti, hogy a króm hat, egy síkban lévõ szénnel létesít kötést, míg a ciklooktatetraén maradék két szénatomja a síkból kihajlik. A hat szénatom körül az elektronok delokalizálódhatnak, a síkból kihajló szénatomok között pedig kettõs kötés található (4. ábra). Összehasonlítva a CpCrCOT és a CpCrBz (Bz=benzol) [12] fotoelektron-spektrumát megállapítható, hogy a két vegyület spektruma a 10 eV alatti tartományban igen sok hasonlóságot mutat. A p -rendszerek ionizációs energiáinak hasonlósága a ligandumok hasonló elektronszerkezetére utal. Jól egyezik még a d-ionizációhoz rendelhetõ elsõ ionizációs energia is. Eltérést mutat a második d-ionizációhoz rendelhetõ sáv. Ennek oka a benzolmolekula és a ciklooktatetraén-molekula hat szénatomjából létrejövõ kváziaromás rendszer eltérõ p-donor jellege.
A (CpCr)2COT fotoelektron-spektrumában 5,7 és 6,3 eV között három, jól elváló csúcs jelentkezik (5. ábra). Ezek intenzitásaránya közelítõleg 2:1:1. A spektrum e jellegzetességébõl megállapítható, hogy a legkisebb ionizációs energiával jellemezhetõ sáv a krómatomokon lévõ egy-egy magános elektronpárhoz rendelhetõ. A másik két csúcs a d-pályák átfedésébõl származó Cr- Cr kötõ molekulapályákhoz tartozik. Ez arra utal, hogy a krómatomok között kettõs kötés van.
A (CO)3CrCOT, a (CO)3MoCOT és a (CO)3WCOT molekulákban a központi fématomhoz három karbonil és egy ciklooktatetraén ligandum kapcsolódik. A COT – a CpCrCOT-hoz hasonlóan – ebben az esetben is h6-helyzetû, ami azt jelenti, hogy hat szénatom kapcsolódik a központi fématomhoz. Alacsony hõmérsékletû röntgen-krisztallográfiás vizsgálatok arra utalnak, hogy a (CO)3MCOT sorozatban – hasonlóan a többi olyan ciklikus poliénhez, amely M(CO)3-csoportot tartalmaz – a polién gyûrû aromás jellege csökken. A (CO)3MCOT sorozat fotoelektron-spektruma legegyszerûbben a (CO)3CrBz színképe alapján sorolható be. Ennek alapján megállapítható, hogy a spektrumokban megfigyelhetõ elsõ sáv az 1a1 és a 2e pályákhoz rendelhetõ, a második sáv pedig az 1e pályáról történõ ionizációhoz tartozik. A további sávok az aromás gyûrû magasabb ionizációihoz, valamint a karbonil ligandumhoz tartoznak. A He(I)/He(II) ionizációs hatáskeresztmetszet vizsgálatok azt igazolják, hogy az elsõ sávban jelentõs szerepet játszanak a fématom d-pályái. A (CO)3CrCOT (és Mo, valamint W analógjának) fotoelektron-spektruma nem mutat hasonlóságot a CpCrCOT fotoelektron-spektrumával annak ellenére, hogy mindegyik komplexben h6-kapcsolatban áll a ciklooktatetraén ligandum a központi fématommal. Amíg a CpCrCOT esetében egy kváziaromás, benzolszerû rendszert alkot a hat, egy síkban lévõ szénatom, a szén–szén távolságok pedig az aromás szén–szén kötéshosszakhoz közelítenek, a (CO)3CrCOT-ban a kötésben részt vevõ szénatomok nincsenek egy síkban, és közöttük rövidebb és hosszabb kötések találhatók.
A kétmagvú (CO)3MoCOTFe(CO)3 jellegzetessége, hogy a Fe(CO)3 molekularészlet h3-, míg a Mo(CO)3 részlet h5-kapcsolatot létesít a ciklooktatetraén ligandummal. A molekula fotoelektron-spektruma igen bonyolult, részletes besorolása az átlapolt sávok miatt nem lehetséges. A spektrumban megjelenõ elsõ, kis ionizációs energiánál jelentkezõ sáv a fém–fém kötéshez rendelhetõ. A következõ sáv a fémek és a ciklooktatetraén-gyûrû közötti kötéshez tartozik, majd ez után következnek a ligandum p-rendszeréhez tartozó ionizációk.
Ezúton szeretném megköszönni témavezetõm,
Dr. Szepes László áldozatkész segítségét,
aki kezdeményezte, irányította és végigkísérte
munkámat.
Ligand–metal interaction in transition metal borohydride and cyclooctatetraene complexes A UV photoelectron spectroscopic study
Ph. D. Thesis
Eötvös Loránd University, Budapest
2000
UV photoelectron spectroscopy is one of the most useful techniques, providing the most direct experimental information about the electronic structure of transition metal systems [2–7].
Transition metal borohydrides (CpZr(BH4)3, Cp2Zr(BH4)2, Cp2Hf(BH4)2, Cp2TaBH4), mono and binuclear cyclooctatetraene complexes ((CO)3FeCOT, [(CO)3Fe]2COT, CpCrCOT, (CpCr)2COT, (CO)3MCOT (M=Cr, Mo, W), (CO)3MoCOTFe(CO)3) were examined by using UV photoelectron spectroscopy.
Transition metal tetrahydroborates have aroused much attention from both structural and practical points of view [8–11]. Structural studies were frequently centred on the ligation of the tetrahydroborate group(s) to the central metal atom; tridentate, bidentate and monodentate cases are known from the literature (Fig.1.).

Cyclooctatetraene (COT) as a ligand shows a great variety in complex chemistry as far as geometry and bonding is concerned. C8H8 can be co-ordinated as a tub shaped tetraolefin or as a planar aromatic anion C8H82-. Its haptocity may have the values 2, 4, 6 and 8, in binuclear complexes h3, h5 and h7 coordination modes also possible (Fig. 2.). In addition, COT can function as a bridging ligand. The m-cyclooctatetraene complexes may also serve as interesting prototypes of compounds containing a metal–metal multiple bond.
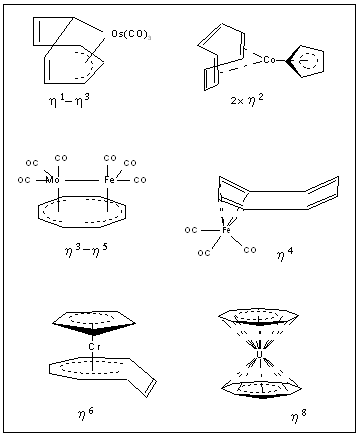
Fig. 2
Tetrahydroborates
In the case of d0 complexes (CpZr(BH4)3, Cp2Zr(BH4)2, Cp2Hf(BH4)2) C5H5 p-ionisation has the lowest energy demand resulting in the first band in the spectrum.
The higher Cp and BH4– ionisations coalesce into the second overlapped band. The d2 complex (Cp2TaBH4) has the same spectral features with an additional band at low energy assigned to the removal of d electrons.
In the case of CpZr(BH4)3, the general feature of the PE spectrum is qualitatively reflected by the EHMO energy-level diagram considering triply bonded borohydride ligands around Zr, while in the case of Cp2Zr(BH4)2 and Cp2Hf(BH4)2 bidentate type borohydride ligands are around the central metal atoms.
Cyclooctatetraene complexes
(CO)3FeCOT and [(CO)3Fe]2COT: The comparison
of the PE spectra of the mono and binuclear iron complexes show that within
the experimental error the first and second ionisation energies are equal,
indicating a similar electronic structure in the close proximity of the
Fe atoms. On the basis of early 1H-NMR studies in the solution
of compound [(CO)3Fe]2COT an equilibrium can be suggested
between an iron–iron bonded species and a complex with two independent
Fe(CO)3 groups (Fig. 3.) [12]. Our UPS results suggest that
in gaseous phase, at the temperature of the inlet probe (210ºC) COT
acts as a bis-h4-ligand bridging
the two iron atoms and no direct bonding exists between them.
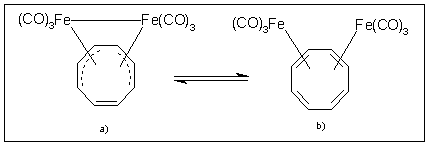
Fig. 3
CpCrCOT and (CpCr)2COT: In the case of the mononuclear CpCrCOT, a coordination mode of h6 for the COT ligand is accepted. This means that the central atom is bound to six quasi planar carbon atoms (Fig. 4.). Accordingly, there is a benzene-like, six membered delocalized electronic system around the Cr atom. As far as ionisation energies are concerned, with the exception of second IE the spectra of CpCrCOT and CpCrBz (Bz=benzene) [13] exhibit good agreement in the energy range below 10 eV. The higher value of the second IE in the COT complex can be related to the different p -donor capabilities of h6-COT and h6-Bz ligands. The low energy part of the photoelectron spectrum of the binuclear (CpCr)2COT contains three well distinguishable bands with 2:1:1 relative intensity ratios (Fig. 5.). This spectral feature can be interpreted as follows: the peak of smallest IE can be attributed to ionisation from the d-type lone pairs localised on the two chromium atoms, while the other two peaks belong to Cr–Cr bonding molecular orbitals. This indicates that there is a double bond between the two chromium atoms.
Fig. 4
In the (CO)3MCOT series (M=Cr, Mo, W) there is h6 type co-ordination around the central metal atom, but the aromacity of the complexed ring is smaller than observed in the CpCrCOT. The PE spectra of the (CO)3MCOT were assigned on the basis of the spectra of the corresponding (CO)3MBz (Bz=benzene) compounds.
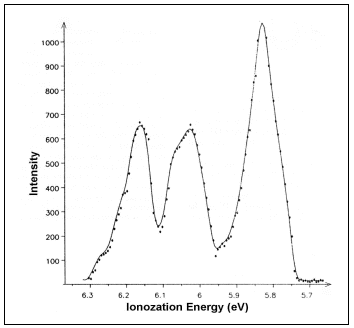
Fig. 5
In the PE spectrum of binuclear (CO)3MoCOTFe(CO)3 the metal-metal bond were identified.
Publications
| Vissza a tartalomjegyzékhez
Back to Contents |
http://www.kfki.hu/chemonet/
http://www.chemonet.hu/ |