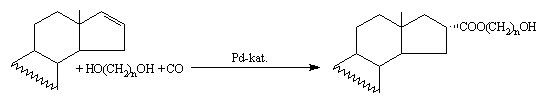
Szteránvázas vegyületek funkcionalizálása átmenetifém komplexek által katalizált homogénkatalitikus reakciókban
Veszprémi Egyetem
Veszprém
2000
I. Elõzmények és célkitûzés
Az utóbbi néhány évtizedben a homogénkatalitikus szintézisek látványos fejlõdésen mentek keresztül és mindinkább nagyobb teret hódított ezen folyamatok ipari alkalmazása. Érthetõ ez, ha figyelembe vesszük, hogy az új technológiák kidolgozásakor egyik alapvetõ igény a folyamatok gazdaságosságán túl az, hogy a lehetõ legkevesebb melléktermék keletkezésével valósítsák meg a gyakorlati jelentõségû vegyületek szintézisét. Mindez kivitelezhetõ szelektív reakciók segítségével, melyekhez a legkézenfekvõbb megoldást a homogénkatalitikus reakciók szolgálják, hiszen kis mennyiségû, katalitikus aktivitással rendelkezõ átmenetifém-komplexek alkalmazásával lehetõség nyílik a kiindulási anyagok magas hozammal történõ átalakítására kemo-, regio- és sztereoszelektív reakciók útján. A hetvenes évektõl komoly nemzetközi versengés indult meg a minél nagyobb szelektivitást eredményezõ katalizátorok szintézise terén, és egyre biztatóbb eredmények születtek az aszimmetrikus reakciókat alkalmazó folyamatok során. Bebizonyosodott, hogy kis mennyiségû optikailag aktív katalizátorok alkalmazásával királis információ vihetõ át a képzõdõ termék nagy mennyiségére. Újabb kihívást jelentett a kutatók számára a minél hatékonyabb királis ligandumok elõállítása, miután kiderült, hogy az optikai hozam jelentõsen függ a katalízis során alkalmazott ligandum szerkezetétõl. Továbbá az érdeklõdés középpontjába kerültek a két- vagy többfémes homogén rendszerek, ezek hatékonyságának vizsgálata fõleg olyan folyamatokban, melyek egymást követõ, több lépéses reakciókból állnak. A homogén katalízis eszköztárának finomkémiai szintézisekre való alkalmazásával lehetõség nyílt arra is, hogy olyan biológiai aktivitással rendelkezõ molekulákat szintetizáljanak, melyek klasszikus módszerekkel nem, vagy nagyon körülményesen állíthatók elõ.
Munkám során érdeklõdésem az önmagukban is biológiai aktivitással rendelkezõ szteroidok felé fordult, és alapvetõ célkitûzésem az volt, hogy a szteroid alapvegyületeket új funkciós csoportokkal lássam el. Kísérleteim alapjául a Veszprémi Egyetem Szerves Kémia Tanszékén elért eredmé
mények, tapasztalatok szolgáltak. Egyszerû molekulák esetében már alkalmazott homogénkatalitikus reakciók útján új szteránvázas vegyületeket szintetizáltam.
A vizsgált reakciók nagy elõnye rendkívüli szelektivitásukban rejlik. Bár a hidroformilezés az egyik legrészletesebben vizsgált reakció, szteroidok homogénkatalitikus hidroformilezésére vonatkozóan kevés irodalmi adat áll rendelkezésünkre, és még kevesebb publikáció jelent meg olyan katalitikus szintézisekrõl, melyekben szteroidokat funkcionáltak több lépésbõl álló folyamat során.
Munkám elsõsorban preparatív jellegû és
bár néhány esetben próbálkoztam a több
lépésbõl álló származékképzés
lépéseit, mechanizmusát tisztázni, nem kívántam
ezeket részletesen vizsgálni.
II. Alkalmazott kísérleti módszerek
A katalizátorként használt fémkomplexek
oxigén-érzékenysége miatt kísérleti
munkám során a beméréseket inert technika alkalmazásával
végeztem, majd a nagy nyomáson végzett reakciók
esetében a katalitikus elegyet Schlenk-technika segítségével
saválló autoklávba juttattam. A konverzió,
illetve a reakcióelegyek összetételének meghatározására
gázkromatográfiás analízist használtam,
valamint ugyanezen módszer segítségével állapítottam
meg a termékek optikai tisztaságát a transzfer-hidrogénezési
kísérleteknél. A termékek reakcióelegybõl
történõ kinyerése oszlopkromatográfiás
módszerrel, azonosításuk MS; GC-MS; IR;
1H-;
13C-NMR
vizsgálatok segítségével történt.
Szerkezeti vizsgálatok esetében a kétdimenziós
NMR technikákat (1H-1H COSY; 1H-13C
HETCOR, NOESY) illetve a polarizáció transzferen alapuló
módszereket (DEPT) vettem igénybe.
III. Új tudományos eredmények
Hidroxi-észter oldalláncot tartalmazó szteroid-származékokat álítottam elõ D16 androsztán kiindulási vegyületek palládium-katalizált karbonilezési reakciójával, diolok jelenlétében. Megállapítottam, hogy a Pd(0) komplexek nem katalizálják a reakciót, míg Pd(II) jelenlétében jó hozammal keletkeztek a termékek. A hõmérséklet és CO nyomás változásának reakciósebességre gyakorolt hatását vizsgálva azt tapasztaltam, hogy az elõbbi nincs jelentõs hatással a reakciósebességre, míg a hõmérséklet emelésével jelentõsen növelhetõ a reakciósebesség. Figyelemre méltó a reakciók kemo-, regio és sztereoszelektivitása, hiszen a fõtermék minden esetben a 16a-izomer. A diolok szerkezete lehetõvé tenné, hogy két szteránvázas kiindulási vegyület diolon keresztül kapcsolódjon egymáshoz, azaz az elsõ lépésben képzõdött hidroxi-észter hidroxil-csoportja egy újabb Pd-acil komplexszel reagáljon. Dimerek keletkezése azonban még több napos reakcióidõ, valamint diolra számított nyolcszoros szteroid felesleg alkalmazásakor sem volt megfigyelhetõ.
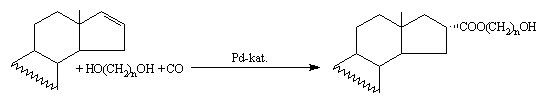
2. Szabad funkciós csoporttal rendelkezõ szteroidok elõállítására nyílt lehetõség a több lépésbõl álló ródium-katalizált hidro-aminometilezési reakciók során. D16 Androsztén és pregnén kiindulási vegyületekbõl jó hozammal és kemoszelektivitással szintetizáltam a hidroxi-aminometil származékokat in situ elõállított ródium-komplexek jelenlétében, aminoalkoholokat alkalmazva reakciópartnerként.
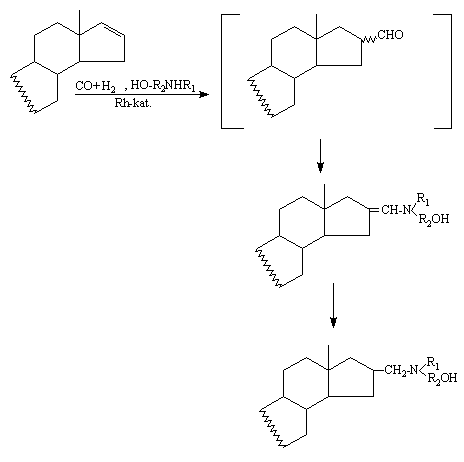
Nagymértékû regioszelektivitást tapasztaltam, a négy lehetséges izomerbõl (16a, 16b, 17a, 17b) csak a 16-os regioizomerek keletkeztek. Megfigyeltem, hogy a ródiumhoz kapcsolódó foszfin ligandum jellege befolyásolja a reakció sztereokémiáját — a bázikusabb foszfin ligandum a sztereoszelektivitás növekedését eredményezte. A 3b-hidroxi-pregna-5,16-dién-20-on — mint szubsztrátum — esetében a 17-es pozícióban levõ szubsztituens nagy térkitöltésének tulajdonítottam az észlelt kiváló sztereoszelektivitást, hiszen az NMR vizsgálatok azt bizonyították, hogy csupán egyetlen izomer, a 16a származék a reakciótermék.
3. Vizsgáltam észter-származékok szintézisének lehetõségét aminoalkoholok jelenlétében, palládium-komplex által katalizált alkoxikarbonilezési reakcióban.
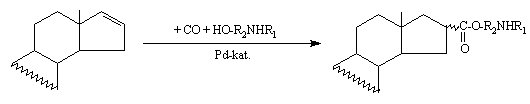
Azt tapasztaltam, hogy sem a Pd(0), sem a Pd(II) komplexek nem alkalmasak az észterezés megvalósításához. Az elvégzett kísérletek azt jelzik, hogy valószínûleg az amino csoport egy katalitikusan inaktív Pd-komplex kialakulásához vezet.
4. Karbonsavamidokkal — mint reakciópartnerekkel — reagálgáltatva a D16 szteroidokat aminometilezési reakciókban enamid-típusú vegyületeket állítottam elõ. Katalizátorként [Rh(nbd)Cl]2 + foszfinból in situ kialakult ródium-komplexek szolgáltak.
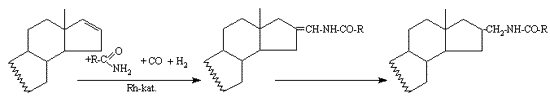
5. Megfigyeltem, hogy bázikus foszfin ligandum alkalmazásakor az amido-metilidén vegyületek gyors redukciója megy végbe.
6. Szteránvázas N-acil-a-aminosavak elõállítására Co-Rh kétfémes rendszer által katalizált homogénkatalitikus hidroformilezési és amidokarbonilezési reakciók kombinációját alkalmaztam. A kiváló hozammal, kemo- és regioszelektív reakciók útján szintetizált aminosav szerkezeti egységet tartalmazó szteroidok az oldalláncban új királis szénatomot tartalmaznak.
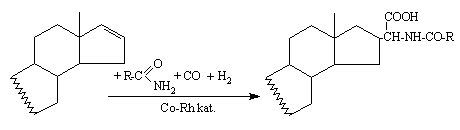
7. A ligandumok szerkezetének diasztereoszelektivitásra gyakorolt hatását vizsgálva megállapítottam, hogy a C-16 epimer elegy összetétele nem függ a ligandumtól azonos Co/Rh arány mellett. Megállapítást nyert, hogy a C-16 sztereoszelektivitását befolyásolja a két fém aránya.
8. Prokirális, illetve a,b-telítetlen ketonok transzfer-hidrogénezéséhez [Ir(cod)(OMe)]2 komplexbõl és három, optikailag tiszta aminodifoszfin ligandumból kialakult katalizátorrendszereket használtam. Hidrogén donorként a reakciókban oldószerként használt propán-2-ol szolgált. A katalitikus adatok alapján arra a következtetésre jutottam, hogy mind a ligandumok királis szénatomján levõ szubsztituens, mind az aminodifoszfin ligandum foszfor atomján levõ szubsztituens befolyásolja a konverziót, a reakció kemo- és enantioszelektivitását.
9. Megállapítottam, hogy bár az egyszerû
vegyületek esetében sikeresen alkalmazhatók az Ir/PNP*
rendszerek kemo-és enantioszelektiv transzfer-hidrogénezési
reakciókban, ezek az átmenetifém katalizátorok
nem alkalmasak a bonyolult, nagy molekulájú szteroidok hasonló
reakcióinak aktiválására.
IV. A tudományos eredmények jelentõsége és hasznosítása
Munkám elsõsorban alapkutatás jellegû, de
a disszertációban ismertetett új termékek egyrészt
lehetõséget kínálnak a váz ”továbbépítésére”,
másrészt mint potenciális gyógyszeralapanyagok
vehetõk figyelembe.
Ezúton fejezem ki köszönetemet témavezetõmnek, Dr. Tõrös Szilárdnak munkám irányításáért, segítõkész, hasznos tanácsaiért.
Functionalization of the steroidal skeleton using transition metal
complexes as homogen catalist
Ph.D. thesis
University of Veszprém
Department of Organic Chemistry
Veszprém
2000
I. Antecedents and aim of the work
In the last decades spectacular progresses have been made in the field of homogeneous catalysis, and a growing importance of these syntheses in industrial processes could be noticed. Understandable this, if we are taking into consideration that during the elaboration of the new technologies one of the main points beyond profitability is to realise the synthesis with minimum quantity of by-products. Convenient routes are the selective reactions, and the most obvious solution for these is furnished by homogeneous reactions. Homogeneous catalysis using chiral metal complexes it may provide large
amounts of chiral products at low cost and also allow the obtainment of specifically tailored products through the fine tuning of either the metal complex or substrate. Challenging problem for researchers is to obtain powerful chiral ligands, since the optical yield could be influenced by the ligand structure. Increasing research efforts have been directed to design and develop efficient binary or multi-catalyst systems.
Aim of this work was the functionalization of the steroidal skeleton.
In the literature only a few articles have been published concerning the
functionalization of the steroids. By using reactions which have already
been applied for simple molecules new steroidal derivatives have been obtained.
Importance of the studied reaction is given by their remarkable selectivity.
II. Experimental procedure
Because of the air sensitivity of the transition-metal complexes used as catalyst all manipulations were performed under argon by using standard inert techniques.
GLC analysis were carried out in order to find out the conversion of
the reactions as well as the product distribution. The ee’s of the products
resulted in hydrogen-transfer reactions were determined similarly with
the help of GC. Separation and isolation of the products was made by column
chromatography on silica gel with different eluents; for caracterization
of them MS, GC-MS, IR and various NMR techniques, including 2D NMR experiments
were applied.
III. New scientific achievements
1. A number of steroidal hydroxy esters have been synthesized by the palladium-catalysed carbonylation of the corresponding D16 androstanes in the presence of diols.
Applying Pd(0) catalysts no reaction took place, while working with Pd(II) complex the products could be synthesized in good yields. The influence of temperature and CO pressure has been investigated. No significant difference was noticed in the reaction rate using various CO pressures at constant temperature, while the rather slow reaction is signifi
cantly accelerated enhancing the reaction temperature and working at constant CO pressure. It’s worthy to be mentioned that the reactions took place in a highly chemo- and regioselective manner; the main product proved to be the 16a-isomer.
The structure of diols would allow the formation of dimeric steroidal product: by reaction of the hydroxy function of the steroidal hydroxy ester formed in the first step with a new Pd-acyl complex a coupled product could be obtained. But formation of diesters in THF was not detected even if an 8:1 ratio of steroid:diol was used.
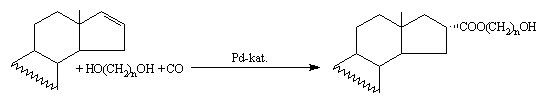
2. New steroid derivatives containing free function group have been produced in a multi-step, rhodium-catalysed hydroaminomethylation reaction. Using in situ rhodium complexes the hydroxy-aminomethyl derivatives have been obtained in moderate to good yield by carbonylation of several D16 androstane and pregnane in the presence of aminoalcohols.

3. Efforts have been made to synthesize ester derivatives by palladium catalysed carbonylation reaction in presence of aminoalcohols.

4. D16 steroids have been functionalized by amides in aminomethylation reactions resulting enamide-type compounds. as catalyst in situ prepared rhodium complexes have been used.

5. While the Rh-PPh3 catalyzed reaction results in the unsaturated amido-methylidene derivatives, in presence of basic PR3 ligands rapid hydrogenation of this compounds takes place.
6. Using a binary rhodium-cobalt system the corresponding steroidal a-amino-acids have been synthesized via amidocarbonylation of the steroids. Obtained in a highly chemo-and regioselective reactions, with excellent yields, the steroids containing the aminoacid moiety have a new chiral carbon atom in the side chain.

7. Diastereoselectivity of the reaction proved to not be influenced by the nature of the phosphine ligand at constant Co/Rh ratio.
It has been found that the stereoselectivity is influenced by the ratio of the two metals.
8. Iridium in association with three different chiral aminodiphosphine ligands has been used to reduce various unsymmetrical or a,b-unsaturated ketones via hydrogen transfer from propan-2-ol. It has been found that the substituent at either the carbon stereocentre or the phosphorus donors in the aminodiphosphine ligands determine both the efficiency and the chemo-, enantioselectivity of the catalysts generated in situ by reaction with [ Ir(cod)(OMe)] 2 .
9. It has been pointed out that the Ir/PNP* systems are not suitable
for reduction of steroids via hydrogen transfer reduction.
IV. Importance and utilization of the scientific achievements
The newly synthesized compounds described in the thesis can serve as
starting materials for further functionalization of the steroidal skeleton,
and on the other hand can be taken into consideration as possible elementary
substance for drugs.
Publications
1. C. Bianchini, L. Glendenning, F. Zanobini, E. Farnetti, M. Graziani,
E. Nagy: Asymmetric hydrogen-transfer reduction of prochiral and a,b-unsaturated
ketones by iridium complexes containing optically pure aminodiphosphine
ligands. J. Mol: Catal. A: Chemical, 132 (1998) 13-19
2. E. Nagy, B. Heil, S. Tõrös: Synthesis of steroidal hydroxy
esters via palladium-catalyzed carbonylation. J. Mol: Catal. A: Chemical,
143 (1999) 229-232
3. E. Nagy, B. Heil, S. Tõrös: Homogeneous catalytic hydroaminomethylation
of steroids with aminoalcohols. J. Organomet. Chem., 586 (1999)
101-105
4. E. Nagy, B. Heil, S. Tõrös: Hydroformylation - amidocarbonylation
of androstene and pregnene derivatives. J. Organomet. Chem. (elfogadásra
vár)
| Vissza a tartalomjegyzékhez
Back to Contents |
http://www.kfki.hu/chemonet/
http://www.chemonet.hu/ |