Kaizer József
Néhány réztartalmú funkcionális
dioxigenáz enzimmodell-rendszer vizsgálata
(Kvercetin 2,3-dioxigenáz, 2-nitropropán dioxigenáz)
Veszprémi Egyetem, Szerves Kémia Tanszék
Veszprém
2001
I. Bevezetés, célkitûzések
A dolgozatban bemutatásra kerülõ kutatómunka céljául a dioxigenáz enzimek mûködésének megismerését tûztük ki egyszerû, fémtartalmú modellrendszerek vizsgálatán keresztül. A modellrendszerek kidolgozása a kvercetin 2,3-dioxigenáz és a 2-nitro-propán dioxigenáz enzimrendszerek megismerésére irányult.
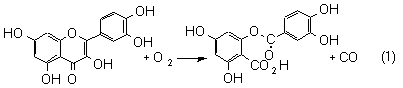
A kvercetin 2,3-dioxigenáz enzim kvercetint, illetve más 3-hidroxi-flavon származékokat alakít át depsziddé (aromás hidroxi-karbonsav észterré) dioxigén felhasználásával (1). Az irodalomból ismert, hogy az enzim aktív centrumában réz(II)ion foglal helyet, de az enzim hatásmechanizmusáról ezidáig kevés ismeret áll rendelkezésünkre.
Mivel mind a kvercetin, mind a réz(II)ion inaktív dioxigénnel szemben, érdemesnek gondoltuk megvizsgálni, hogy az enzim és ezen belül a fém miként fejti ki hatását az oxigénezési reakcióban. Ennek érdekében a következõ feladatokat tûztük ki célul:
A szubsztrátum egyszerû redox- és nem redoxaktív fémtartalmú komplexeinek elõállítása és jellemzése.
Az elõállított komplexek oxigénezési reakcióinak, mint a fém koordinációs övezetében lejátszódó egyedi lépések kinetikai vizsgálatát elvégezve információt szerezni a szubsztrátum és/vagy a dioxigén aktiválásának mechanizmusáról, és ezen keresztül tisztázni az enzim aktív centrumában helyet foglaló fém szerepét. A szubsztrátumokhoz hasonló szerves vegyületek fémkomplexek által katalizált oxidációs reakcióinak vizsgálata, melyek preparatív szempontból is érdekességgel bírnak.
A 2-nitro-propán dioxigenáz intracellurális enzim, amely katalizálja az alifás nitrovegyületek lebontását a megfelelõ karbonilvegyületté és nitritté (2).
A részletes enzimológiai vizsgálatok azt mutatták, hogy az enzim prosztetikus csoportként flavin-adenin-dinukleotidot (FAD) és vasiont tartalmaz. Az irodalomban számos FAD-tartalmú modell ismeretes, de fémtartalmú modelleket ezidáig kevesen vizsgáltak. Annak eldöntésére, hogy a redoxaktív sajátságú fémnek lehet-e szerepe az enzimfolyamatban, réztartalmú modellek kidolgozását és vizsgálatát tûztük ki célul.
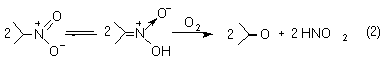
II. Eredmények
II.1. Kvercetin 2,3-dioxigenáz modellrendszerek elõállítása és vizsgálata
A kvercetin 2,3-dioxigenáz enzim hatásmechanizmusának vizsgálatát redoxaktív (réz(I), réz(II)) és nem redoxaktív fémtartalmú (kálium(I), cink(II)) mûködési modellek elõállításán keresztül végeztük. A modellvegyületek szintéziséhez 4'R-flaH-t (flaH = 3-hidroxi-flavon, R = H, CH3, Cl, OCH3, NO2), trifenil-foszfint (PPh3) és nitrogéntartalmú (1,10-fenantrolin (phen), 3,3-imino-bisz(N,N-dimetil-propil-amin) (idpa), 1,3-bisz(2-piridil-imino)-izoindolin (indH), 1,4-(di-2-piridil)-amino-ftalazin (papH2)) ligandumokat használtunk fel.
A következõ komplexeket állítottuk elõ és határoztuk meg a szerkezetét:
[CuI(4R-fla)(PPh3)2, [CuII(4R-fla)2], [CuII(idpa)(4R-fla)2]ClO4, [CuI(fla)(indH)], [CuII(fla)(indH)]ClO4, [CuII(fla)(ind)], [CuII(fla)(phen)]ClO4, [CuII(fla)(phen)2]ClO4, [CuII(fla)2(phen)], [CuI(fla)(papH2)], [CuII(fla)(papH)], [CuII2(fla)2(papH2)(ClO4)2], K(4R-fla) [CuII2(fla)2(pap)], [CuII2(fla)2(OH)(papH)] és [ZnII(idpa)(4R-fla)2]ClO4.
A felsorolt rézkomplexek oxigénezési reakcióiban
a flavonoláto ligandum C2-C3 kötésének
oxidatív felhasadása minden esetben megfigyelhetõ
volt. Termékként szén-monoxid szabadult fel és
O-benzoil-szaliciláto- réz(I)- és réz(II) komplexek
keletkeztek, melyek szerkezetét spektroszkópiai (IR, UV-VIS,
NMR), mágneses és néhány esetben röntgendiffrakciós
mérés segítségével határoztuk
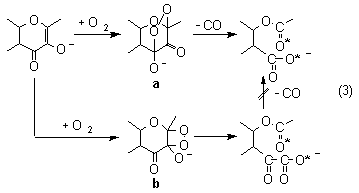
meg. Igazoltuk továbbá, hogy a reakciók az esetek
többségében az enzimatikus folyamatban feltételezett
endoperoxid (a) intermedieren keresztül játszódik
le (3). Kivételt képez a [CuII(fla)2(phen)]
komplex oxigénezése, ahol a reakció az enzimatikus
úttól eltérõ mechanizmus szerint, un. 1,2-dioxetán
(b) intermedier kialakulásán keresztül megy végbe,
termékként [(flavonoláto)-(1,10-fenantrolin)-(O-benzoil-fenilglioxiláto)-réz(II)]
komplexet eredményezve. A dioxigén atomjainak beépülési
helyeit (*) mindkét mechanizmus esetében meghatároztuk
18O2-al végzett kísérletek segítségével.
A redoxaktív fémtartalmú komplexek (Cu(I), Cu(II)) oxigénezési reakcióiban - a reakciókinetikai mérések eredményei alapján - a sebességmeghatározó lépéseket tekintve két esetet különböztethetünk meg. A réz(I)tartalmú vegyületek esetében a réz(I)komplexek közvetlen oxidációja (4),
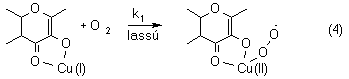
míg réz(II)komplexek esetében az intramolekulás
elektronátmenettel leírható elõegyensúlyban
keletkezõ réz(I)ion dioxigénnel történõ
reakciója (5) a sebességmeghatározó lépés.
Az enzimfolyamatban tehát a réz(II)ion szerepét a
redoxaktív tulajdonságával lehet magyarázni,
amely lehetõvé teszi a dioxigén és egyben a
szubsztrátum aktíválását is
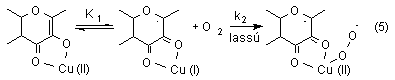
A nem redoxaktív fémet (K, Zn) tartalmazó komplexek
(sók) oxigénezési reakcióiban termékként
a megfelelõ O-benzoil-szaliciláto komplexekhez, illetve sókhoz
jutottunk. A reakciókinetikai vizsgálatok bimolekulás
sebességi egyenleteket eredményezett, mely alapján
javaslatot tettünk a reakciók mechanizmusára. Feltételezésünk
szerint a sebességmeghatározó lépés
itt is a dioxigénnel való reakció, de a rézkomplexekkel
szemben a dioxigént itt a flavonolát-anionból keto-enol
átalakulással levezethetõ karbanion redukálja,
nem pedig a fémion (6).
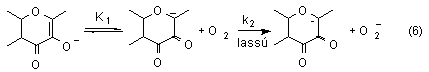
A modellvegyületek elõállítása és autooxidációs reakcióik tanulmányozása után megvizsgáltuk katalitikus aktivitásukat a 3-hidroxi-flavon oxigénezési reakciójában. A reakciókat DMF-ban végezve megmutattuk, hogy a cinktartalmú komplexek kivételével az összes komplex katalitikus aktivitással bír és minden esetben az enzimatikus útnak megfelelo O-benzoil-szalicilsav képzõdik, feltehetõleg az a intermedieren keresztül. A legnagyobb mértékû átalakulást a kétmagvú komplexek esetén észleltük.
II.2. Nitroalkánok oxigénezése réz jelenlétében
A 2-nitro-propán dioxigenáz enzim hatásmechanizmusának vizsgálatát réztartalmú modellrendszerek elõállításán keresztül végeztük el.
Megmutattuk, hogy az elemi réz aprotikus oldószerben (DMF,
Py), nitrogén donoratomokat tartalmazó ligandumok (phen,
bpy, tmeda) jelenlétében katalizálja a nitrovegyületek
oxigénezését a megfelelõ karbonilvegyületté
(7).
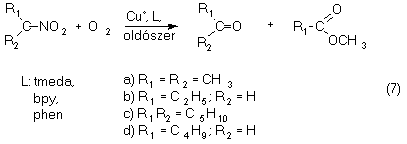
Protikus oldószer (MeOH) alkalmazása esetében a megfelelõ karbonilvegyület keletkezése mellett észterképzodés is megfigyelhetõ volt, ami az oxigénezési reakcióval párhuzamosan lejátszódó acilézési folyamattal magyarázható.
Igazoltuk, hogy a vizsgált reakciókban a katalitikus hatást az in situ körülmények között kialakuló [bisz(nitronáto)-(ligandum)-réz(II)] és annak oxidációs terméke a [bisz(nitrito)(ligandum)-réz(II)] komplex fejti ki. A katalitikus reakció kinetikai vizsgálata alapján javaslatot tettünk a reakció mechanizmusra.
Köszönöm Dr. Speier Gábor egyetemi tanár úrnak, hogy munkám elvégzését lehetõvé tette, hasznos tanácsaival segítette. Köszönettel tartozom témavezetõmnek, Dr. Balogh Istvánné c. egyetemi docensnek, aki munkámat mindvégig figyelemmel kísérte, hasznos tanácsaival és ösztönzésével nagyban hozzájárult a dolgozat elkészüléséhez.
Studies of Some Copper-containing Functional Dioxygenase Enzyme Models
(Quercetin 2,3-dioxygenase, 2-Nitropropane dioxygenase)
Ph.D. thesis
University of Veszprém
Department of Organic Chemistry
Veszprém
2001
I. Introduction
Biological oxygenations catalyzed by oxygenases are very important processes in nature for the metabolism of various organic substances. The oxygenases are metal-containing proteins and a fair number of them utilizes copper and/or iron at their active sites. Biomimetic chemistry is a useful tool for the determination of the possible structure of the active site, binding mode of the substrate and the reaction pathways of the enzyme actions. Model reactions have been investigated to elucidate the action of two metal-containing enzymes, the copper-containing quercetin 2,3-dioxygenase and iron-containing 2-nitropropane dioxygenase.
Quercetin 2,3-dioxygenase is a copper-containing dioxygenase with copper(II) at the active site, which catalyzes the oxygenolysis of 3-hydroxyflavones to the corresponding depsides as a result of the oxidative cleavage of the heterocyclic ring (equation 1).
Since only limited data on quercetinase are available in the literature
and the role of the copper ion at its active site is still obscured we
set the ultimate goal to prepare and characterize such complexes which
would serve as structural models and give possibilities to study relevant
stoichiometric and catalytic oxygenation reactions in order to disclose
the possible pathway of the enzymatic reaction.

2-Nitropropane dioxygenase is an enzyme containing iron ion and FAD co-factor at its active site, which catalyzes the oxidative denitrification of primary and secondary nitro compounds to aldehydes or ketones (equation 2).
In the literature there are some FAD-containing model systems, but the role of the iron ion is still obscured. Model reactions have been investigated to elucidate the action of iron-containing 2-nitropropane dioxygenase.
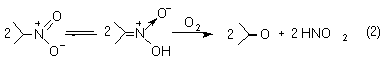
II. Results
II.1. Studies on quercetinase enzyme models
Although there were suggestions for the coordination of quercetin to copper(II) in the literature, no well-characterized model compounds have been described. In order to obtain information of the possible binding of the substrate and to use them in oxygenation reactions, first we attempted to prepare stable copper(I), copper(II), zinc(II) and potassium flavonolates with different auxiliary ligands such as triphenylphosphine (PPh3), 1,10-phenanthroline (phen), 1,3-bis(2-pyridylimino)isoindoline (indH), 1,4-di(2-pyridyl) aminophthalazine (papH2) and 3,3-iminobis(N,N-dimethylpropylamine) (idpa).
The complexes [CuI(4R-fla)(PPh3)2, [CuII(4R-fla)2], [CuII(idpa)(4R-fla)2]ClO4, [CuI(fla)(indH)], [CuII(fla)(indH)]ClO4, [CuII(fla)(ind)], [CuII(fla)(phen)]ClO4, [CuII(fla)(phen)2]ClO4, [CuII(fla)2(phen)], [CuI(fla)(papH2)], [CuII(fla)(papH)], [CuII2(fla)2(papH2)(ClO4)2], K(4R-fla) (R = H, CH3, Cl, OCH3, NO2), [CuII2(fla)2(pap)], [CuII2(fla)2(OH)(papH)], and [Zn(idpa)(4R-fla)2]ClO4 have been prepared and their structures characterized by X-ray diffractometryc and spectroscopic methods.
Oxygenation of these complexes in most cases resulted in O-benzoylsalicylato complexes and carbon monoxide (equation 3) via an endoperoxide intermediate (a). However, in the case of [CuII(fla)2(phen)] complex the oxygenolysis of the coordinated flavonolate takes place through an 1,2-dioxetane intermediate (b) resulting in (O-benzoylphenylglyoxylato) copper(II) complex. Labelling experiments with an 18O2-16O2 mixture in both cases evidenced the incorporation of both 18O atoms of 18O2 into the substrate.

Kinetic measurements on stoichiometric oxygenation made it possible to understand the role of the metal ion and to propose a probable mechanism for this curious reaction. Oxygenation of flavonolato Cu(I) complexes established a second-order overall rate expression, indicating that the rate-determining step must be bimolecular, namely the reaction of Cu(I) ion with dioxygen forming superoxo copper(II) complexes (equation 4).
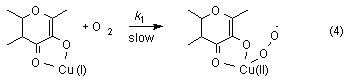
The oxygenolysis of flavonolato copper(II) complexes follow the rate law -d[Cu(II)]/dt = k[Cu(II)][O2]. In that case copper(II) flavonolate in a fast preequilibrium undergoes intramolecular electron transfer from the ligand fla- to Cu(II) resulting in a copper(I) flavonoxy radical compex. After that the biradical dioxygen reacts in an oxidative addition to the copper leading to a superoxo copper complex. We believe that the former is the rate-determining step (equation 5).
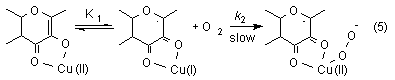
Oxygenation of potassium and zinc flavonolates in DMF lead to the corresponding O-benzoylsalicylate and carbon monoxide. Kinetic measurements resulted in the rate law -d[fla-]/dt = k[fla-][O2]. The second order rate expression suggest that the rate-determining step is the reaction between the flavonolate ion and dioxygen forming flavonoxy radical and superoxide ion (equation 6).
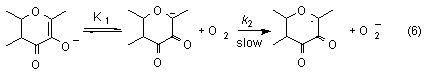
Using copper(I) and copper(II) flavonolate complexes as catalysts in
the reaction of flavonol and dioxygen, oxidative ring cleavage took place
leading to the corresponding depside and carbon monoxide. In case of zinc
flavonolate oxygenated products havent been observed.
II.2. Copper-mediated Oxidation of Nitroalkanes
Using metallic copper as catalyst in aprotic solvents such as DMF, various nitroalkanes can be easily converted to the corresponding carbonyl compounds and nitrous acid in the presence of N-donor ligands. In alcoholic solvent (methanol) the corresponding esters as minor products are also formed (equation 7).
From the two systems above nitrito- and nitronato-copper(II) complexes
as catalitically active species have been isolated and characterised by
spectroscopic methods. Kinetic measurements on the catalytic oxygenation
made it possible to understand the role of the copper ion and to propose
a probable mechanism for these reactions. Kinetic data gave evidence for
an intermolecular dioxygenase type catalysis.
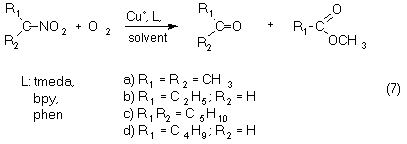
References
1. É. Balogh-Hergovich, J. Kaizer, G. Speier, M. Czugler: J.
Inorg.
Biochem., 51. 148. 1993.
2. É. Balogh-Hergovich, J. Kaizer, G. Speier, G. Huttner, L.
Zsolnai:
J. Inorg. Biochem., 59. 687. 1995.
3. É. Balogh-Hergovich, J. Kaizer, G. Speier: Chem. Lett.,
573. 1996.
4. É. Balogh-Hergovich, J. Kaizer, G. Speier: Inorg. Chim.
Acta, 256. 9. 1997.
5. É. Balogh-Hergovich, J. Kaizer, G. Speier, G. Huttner, L.
Zsolnai:
J. Inorg. Biochem., 67. 75. 1997.
6. É. Balogh-Hergovich, J. Kaizer, G. Speier, V. Fülöp,
L. Párkányi:
Inorg. Chem., 38. 3787. 1999.
7. É. Balogh-Hergovich, J. Kaizer, G. Speier, G. Argay, L. Párkányi:
J.
Chem. Soc.,.Dalton Trans., 3847. 1999.
8. É. Balogh-Hergovich, J. Kaizer, G. Speier, G. Huttner, P.
Rutsch:
Acta Crystallogr. C55. 557. 1999.
9. É. Balogh-Hergovich, J. Kaizer, G. Speier, G. Huttner, L.
Zsolnai:
Inorg. Chim. Acta, 304. 72. 2000.
10. É. Balogh-Hergovich, J. Kaizer, G. Speier, G. Huttner, A.
Jacobi:
Inorg. Chem., 39. 4224. 2000.