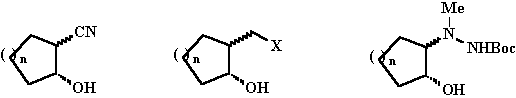
1-4 5-14 15-18
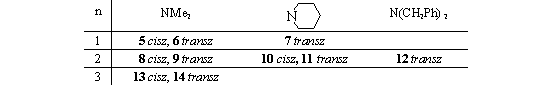
n=1,2; cisz, transz n=1,2,3; cisz, transz
n=1,2; cisz, transz![]()
1. ábra
Forró Enikõ
2-Szubsztituált cikloalkanolok lipáz-katalizálta kinetikus rezolválása
Szegedi Tudományegyetem,
Gyógyszerkémiai Intézet
2000
1. Elõzmények és célkitûzések
A királis vegyületek, természetes anyagok elõállítása mindig is kihívást jelentett a preparatív szerves kémikusok számára, ám az elméleti érdekességen túlmenõen az enantiomerek szintézise, illetve szétválasztásuk problémája a királis gyógyszervegyületek körében szerzett tapasztalatok alapján vált gyakorlati szempontból is kiemelkedõ fontosságúvá. Az enantiomerek elõállítására kidolgozott enzimes rezolválások egyre nagyobb teret hódítanak napjaink szerves kémiájában. A királis vegyületek körében az 1,2- és 1,3-aminoalkoholok, illetve prekurzoraik mind biológiai, mind kémiai szempontból igen jelentõsek.
Munkám célja különbözõ 2-szubsztituált cikloalkanol: 2-ciano-cikloalkanolok (1-4), 2-[ (dialkil-amino)-metil] -cikloalkanolok (5-14), valamint 2-(Nb -t-butoxikarbonil-Na -metilhidrazino)-cikloalkanolok (15-18; 1. ábra) enzim-katalizálta rezolválási lehetõségeinek vizsgálata volt. Tanulmányozni kívántuk az enzimes reakció körülményeinek (enzim típusa, valamint mennyisége, oldószer, acil donor, hõmérséklet, jelenlevõ víz mennyisége) reakció szelektivitására és sebességére gyakorolt hatását. Célunk volt a gyûrû tagszáma és az enzimes reakció sebessége, valamint szelektivitása közötti összefüggések vizsgálata is.

1-4 5-14 15-18
n=1,2; cisz, transz n=1,2,3; cisz, transz
n=1,2; cisz, transz![]()
1. ábra
2. Alkalmazott vizsgálati módszerek
Az enzimes elõkísérleteket félmikro méretben végeztem. A racém 1-18 modellvegyületek szintézisét irodalmi utakon valósítottam meg. Az acilezési reakciók elõrehaladását és a képzõdött észter, valamint el nem reagált alkohol enantiomer tisztaságát királis töltetû oszloppal felszerelt gáz- illetve folyadékkromatográf segítségével állapítottam meg. Az 1-18 vegyületek gramm-mennyiségû enzimes rezolválása során keletkezett észter (1a-18a) és alkohol (1b-18b) enantiomer-párokat oszlop-kromatográfiásan választottam szét. A munkám során összesen elõállított 52 enantiomert ľ közülük 50 új ľ elemi analízissel, NMR és esetenként tömegspektrometriás vizsgálatokkal jellemeztem.
3. Eredmények és értékelésük
3.1. Munkám során tanulmányoztam a racém cisz- és transz-2-ciano-ciklopentanol és -ciklohexanol (1-4)[1], a cisz- és transz-2-[(dialkil-amino)-metil]-ciklopentanol, -ciklohexanol és -cikloheptanol (5-14), [2-5] valamint a cisz- és transz-2-(Nb -t-
butoxi-karbonil-Na -metilhidrazino)ciklopentanol és -ciklo-hexanol (15-18) [6] enzim-katalizálta rezolválásának lehetõségeit szerves oldószerekben (2-4. ábra). Valamennyi vizsgált vegyület esetében a lipáz-katalizálta rezolválási reakciók a szekunder OH csoport aszimmetrikus acilezésén alapultak.
3.2. A 2-ciano-cikloalkanolok (1-4) aszimmetrikus észterezése céljából (2. ábra) számos acildonort (vinil-észter, savanhidrid, 2,2,2-trifluor-etil-észter) vizsgáltam dietil-éterben, PS lipáz (Pseudomonas cepacia) katalízissel [1]. Savanhidridek esetében a szelektív acilezéssel párhuzamosan az 1b-4b és a felszabadult sav között lejátszódó enzimes reakciók az 1a-4a észterek, míg a 2,2,2-trifluor-etil-észterek esetében az 1a-4a észterek és reakció során felszabadult trifluor-etanol között lejátszódó átészterezési reakciók az 1b-4b alkoholok enantiomer tisztaságának csökkenését eredményezték. Vinil-acetáttal kiváló enantio-szelektivitást (E >200) értem el, a reakció során keletkezett vinil-alkohol irreverzibilisen acetaldehiddé tautomerizál, átészterezési mellék-reakció nem játszódik le.
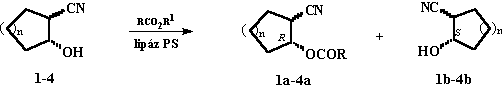
1 n=1, transz; 2 n=1, cisz; 3 n=2, transz; 4 n=2, cisz
2. ábra
3.3. A 2-[(dialkil-amino)-metil]-cikloalkanolok (5-14)
enzimekkel végzett elõkísérletei során
megállapítottam, hogy a PS lipáz mellett mind a Novozym
435 (Candida antarctica B lipáz), mind az AK lipáz
(Pseudomonas fluorescens) igen jó enantioszelektivitással
katalizálta a reakciókat [2-5].
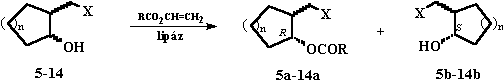
Az acil donorok (vinil-észterek) vizsgálata során megállapítottam, hogy az acil lánc növekedésével a továbbra is kiváló enantioszelektivitással lejátszódó reakciók sebessége általában nagymértékben csökkent [2,3,5].3. ábra
Azt tapasztaltam, hogy az oldószer jelentõsen befolyásolta mind az enzim szelektivitását, mind pedig a reakció sebességét. Optimálisnak a dietil- és diizopropil-étert találtam [2-6].
Az 5-14 alkoholok lipáz PS- és Novozym-katalizálta acetilezésének enantioszelektivitása az enzim mennyiségétõl függetlennek bizonyult (E >200), azonban a reakciósebesség 30 mg ml-1 Novozym, illetve 50 mg ml-1 PS lipáz esetében volt optimális [2-4].
Az 5a-14a észterek spontán metanolízis folytán metanolban, szobahõmérsékleten, az enantiomer tisztaságot megtartva a megfelelõ alkohol enantiomerekké alakultak [2,3,5].
3.4. A 2-(Nb -t-butoxikarbonil-Na -metilhidrazino)-cikloalkanolok (15-18) lipáz-katalizálta szelektív acilezésére vizsgált lipázok közül a PS lipáz és Novozym 435 mellett az AK és PPL (sertés hasnyálmirigy lipáz) szintén jó enantioszelektivi-tást biztosított diizopropil-éterben [6].
Az elõkísérletek során, mind a PS lipáz, mind a Novozym jelenlétében, a 15 és 16 vegyület aszimmetrikus acilezésére vizsgált vinil-acetáttal gyorsabb mint vinil-butiráttal [6].
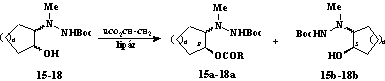
15 n=1, transz; 16 n=1, cisz; 17 n=2, transz; 18 n=2, cisz
4. ábra
3.5. Az acilezés valamennyi vizsgált vegyület esetében, a Kazlauskas modellnek megfelelõen R-szelektivitást mutatott, azaz R-észtert és S-alkoholt eredményezett. Az abszolút konfiguráció bizonyítását a vegyületcsaládok egy-egy kiválasztott tagja esetében végeztem el úgy, hogy azokat egy-egy ismert abszolút konfigurációjú vegyületté alakítottam.
3.6. Összefüggést találtam a cikloalkángyûrû tagszáma és az enzimes reakció sebessége között: a ciklopentánvázas 2-szubsztituált cikloalkanolok enantioszelektív acilezése gyorsabban játszódótt le mint a ciklohexánvázas és sokkal gyorsabban mint a cikloheptánvázas cikloalkanolok esetében [1-6]A transz izomerek, a 2-ciano-cikloalkanolok kivételével sokkal gyorsabban reagáltak cisz társaiknál.
A szerzõ köszöni témavezetõjének, Dr. Fülöp Ferenc tanszékvezetõ egyetemi tanárnak a munkája irányítását és támogatását.
Lipase-catalysed kinetic resolution of 2-substitued cycloalkanols
Ph. D. Thesis
Institute of Pharmaceutical Chemistry,
University of Szeged
2000
Racemates of cis- and trans-2-cyanocyclo-pentanol and -cyclohexanol (1-4) [1], cis- and trans-2-dialkylaminomethylcyclopentanol, -cyclohexanol and -cycloheptanol (5-14) [2-5] and Boc-protected cis- and trans-2-methylhydrazinocyclopentanol and -cyclohexanol (15-18, Fig. 1.) [6] were resolved through lipase PS (from Pseudomonas cepacia) or Novozym 435 (from Candida antarctica B)-catalysed asymmetric acylation.

1-4 5-14 15-18
n=1,2; cis, trans n=1,2,3;
cis, trans n=1,2;
cis,
trans ![]()
Fig.1.
The lipase PS-catalysed acetylations of 1-4 performed in diisopropyl ether showed excellent enantioselectivity (E >200) with vinyl acetate, allowing the simultaneous preparation of the unreacted (1S,2S) alcohol and (1R,2R) ester enantiomers in the case of the cis isomers, and the (1S,2R) alcohol and (1R,2S) ester enantiomers in the case of the trans isomers, at 50% conversion [1].
Extensive lipase screening for compounds 5-14 indicated that,
besides lipase PS, Novozym 435 was also an excellent catalyst, directing
the acetylation with high enantioselectivity (E >200) [2-5].

1 n=1, trans; 2 n=1, cis; 3 n=2, trans; 4 n=2, cis
Fig. 2.
It was found that the acylations of 5-14 with various vinyl esters in the presence of lipase PS or Novozym 435 proceeded with the best combination of activity and selectivity when vinyl acetate was used as acylating reagent [2,3,5]. After a wide investigation of solvents, ether solvents were chosen as the most favourable type of solvent, which led to excellent enantioselectivity [2-6].


Fig. 3.
Reaction rates were markedly affected by the quantity of the enzyme: the reactivity for the acetylations of 5-14 clearly passes through a maximum at a lipase PS content of 50 mg ml-1 and a Novozym 435 content of 30 mg ml-1[2-4]. The esters produced by the (R) selective acetylation of 5-14 underwent spontaneous conversion to the corresponding alcohols in methanol at room temperature, without loss of enantio-purity [2,3,5].
Successful enantioselective acylation of 15-18 was possible, in ethereal solution, when Novozym 435 or lipase PS was used as catalyst and vinyl acetate or vinyl butyrate (E usually >200) as acyl donor [6].
The size of the cycloalkane ring had a clear effect on the rate of enantioselective acylation: the acetylations of the five-membered cycloalcanols proceeded more rapidly than those of the six-membered ones and much more rapidly than those of the seven-membered systems [1-6]. It can also be concluded that the trans isomers react more rapidly than the cis counterparts, the only exception being found in the case of 2-cyanocyclohexanols.
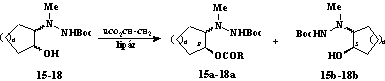
15 n=1, trans; 16 n=1, cis; 17 n=2, trans; 18 n=2, cis
Fig. 4.
In good correlation with the ôKazlauskas ruleö, in all cases, the (R) enantiomer is acylated faster than the (S) enantiomer, yielding an (R) ester and an (S) alcohol, which products from large-scale experiments were separated by column chromatography.
During these studies, a total of 18 racemates of cis- and trans-2-substituted cycloalkanols (1-18) were resolved by using lipases as catalysts, and 52 enantimers (50 of them new) were characterized by NMR, elemental analysis and ocassionally MS.
Publications
1. Enikõ Forró, Katri Lundell, Ferenc Fülöp,
Liisa T.
Kanerva: Preparation of the stereoisomers of 2-cyanocycloalkanols by
lipase-catalysed acylation;
Tetrahedron: Asymmetry 1997,
8, 3095-3099.
2. Enikõ Forró, Liisa T. Kanerva, Ferenc Fülöp:
Lipase-catalysed resolution of 2-dialkylamino- methylcyclo-hexanols; Tetrahedron:
Asymmetry 1998, 9, 513-520.
3. Forró Enikõ Liisa T. Kanerva, Fülöp
Ferenc: 2-[(Dialkil-amino)-metil]-1-ciklohexanolok enzimes rezolválása;
Magy.
Kém. Foly. 1998, 104, 437-443.
4. Forró Enikõ, Fülöp Ferenc: 2-[(Dialkil-amino)-metil]-1-ciklanolok
enzimes rezolválása. Összehasonlító vizsgálatok;
Acta Pharm. Hung. 1999, 69, 155-159.
5. Enikõ Forró, Ferenc Fülöp: Enzymatic
resolution of 2-dialkylaminomethylcyclopentanols and cyclo-heptanols; Tetrahedron:
Asymmetry 1999, 10, 1985-1993.
6. Enikõ Forró, Zsolt Szakonyi, Ferenc Fülöp:
Enzymatic resolution of (±)-2-(Nb -t-Butoxycarbonyl-Na
-methylhydrazino)cycloalkanols;
Tetrahedron:
Asymmetry 1999,
10, 4619-4626.
| Vissza a tartalomjegyzékhez
Back to Contents |
http://www.kfki.hu/chemonet/
http://www.chemonet.hu/ |