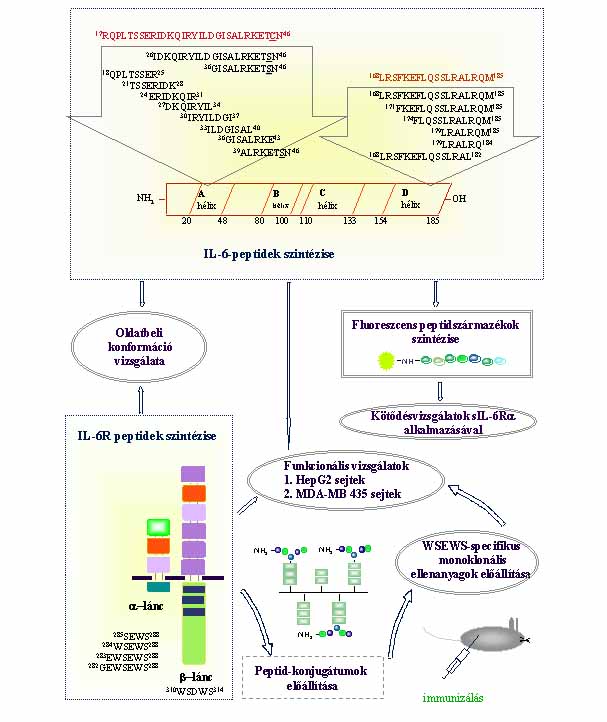
1. ábra. A kutatás gondolatmenete és célkitûzései
Az Interleukin-6 hatásért felelõs régiók vizsgálata szintetikus peptidekkel
Eötvös Loránd Tudományegyetem
1999
Értekezésemben szintetikus IL-6 peptidek segítségével
azt vizsgáltam, hogy a fehérje N- és C terminális
szakaszán mely régió(k) felelõsek az IL-6 által
kiváltott biológiai hatásért, illetve az IL-6R
kötõdésért. Az N- és C-terminális
régió 17-46 és 168-185 szakaszát
szintetikus peptidekkel modelleztem annak érdekében, hogy
a régiók szerepét ilyen megközelítéssel
vizsgáljam. Az IL-6R esetében tanulmányozni kívántam
a WSXWS motívum szerepét. Ezért döntöttem
az ezen szakaszokat reprezentáló peptidek szintézise,
valamint peptidkonjugátumok felhasználásával
a WSEWS-specifikus monoklonális ellenanyagok elõállítása
és vizsgálata mellett. Az a-lánc esetében a
WSEWS pentamer a 284-288 régióban van jelen, míg
a b-lánc esetében a WSDWS részlet a
310-314
szakaszon található. Tekintettel arra, hogy az oldatbeli
konformációnak fontos szerepe lehet a biológiai hatás
kiváltásában az IL-6 és IL-6R peptidek oldatbeli
térszerkezetét is tanulmányoztam.
A peptidek szintézise és jellemzése
Az N-terminális 17-46 szakaszt 8 átlapoló oktapeptiddel, illetve 3, a régiót részben vagy teljes egészében lefedõ peptiddel reprezentáltam. Mutáns fehérjékre vonatkozó irodalmi adatok alapján a 45Cys aminosav szerinnel helyettesíthetõ, ennek megfelelõen a peptidekben Cys>Ser cserét alkalmaztam. Szintetizáltam továbbá olyan peptideket is, amelyekbe (irodalmi adatok alapján meghatározott) kritikus pozíciókban aminosavcseréket hajtottam végre. Elkészítettem egy, a 168-185 C-terminális szakaszt magában foglaló peptidet, valamint hét, az N- és a C-terminális felõl szisztematikusan rövidített vegyületet.
A peptideket a szekvencia elemzése után, az aminosavak minõségétõl függõen Boc/Bzl, Fmoc/tBu, valamint ezek kombinációjával építettem. A választott stratégiától függõ hasítás után a nyers peptidek tisztasága 75-85 %-os volt, az RP-HPLC tisztítást követõen homogenitásuk pedig elérte a 95-99 %-ot. A C-terminálison metionint tartalmazó peptidamidok szintézisére az Fmoc/tBu módszerrel polisztirol alapú gyantán bizonyult hatékonynak.
Az IL-6Ra "WSEWS-peptideket", valamint a gp130 (IL-6Rb) WSDWS peptidet
(triptofán tartalmukat figyelembe véve) Boc/Bzl stratégiával,
N2 atmoszférában vagy Fmoc/tBu módszerrel
építettem fel. A hasításokat követõen
a nyers peptidek tisztasága 80 % körüli volt, tisztításukat
követõen pedig 95-99 %-nak adódott.
Fluoreszcens peptidszármazékok szintézise és jellemzése
A kötõdésvizsgálatokhoz naOx-OEt-nal jelzett peptideket állítottam elõ. A peptideket Boc/Bzl, Fmoc/tBu és Fmoc/tBu/MBHA stratégia szerint építettem fel. A fluorofor csoport bevitelét szilárd hordozón (az utolsó Na-védõcsoport hasítását követõen), valamint Na-naOx-aminosavszármazék beépítésével Boc/Bzl és Fmoc/tBu stratégia szerint is megvalósítottam. Peptideket néhány esetben oldatban is reagáltattam naOx-OEt-nal.
Megállapítottam, hogy a peptid és a naOx-csoport
között létrejött kötés a szilárdfázisú
peptidszintézis körülményei között stabil.
Az általam választott peptidek esetében az oldatban
való jelölési stratégia kevésbé
bizonyult alkalmazhatónak, mert a nyerstermék tisztítása
nagy veszteségekkel volt megvalósítható. A
peptidek spektroszkópiai jellemzése azt bizonyította,
hogy a jelölt peptidek elõnyös fluoreszcencia paramétereket
(kvantumhatásfok, emissziós és gerjesztési
maximumok helye és távolsága) mutatnak, a peptidlánc
összetétele jelentõs mértékben nem befolyásolja
ezeket a sajátságokat. Megállapítottam, hogy
a naOx-peptidek fluoreszcencia intenzitása változik abban
az esetben, ha a jelölt peptid kötõdik a sIL-6Ra-hoz.
Az IL-6 peptidek oldatbeli konformációja
Predikciós számítások és CD mérések segítségével megállapítottam, hogy az IL-6 fehérje A-hélix (20-48) valamint a D-hélix (154-185) régióját részben modellezõ peptidszakaszok kifejezetten alkalmasak és képesek rendezett szerkezet oldatbeli felvételére.
A 17-46 szakaszt reprezentáló oktapeptidek
között néhány peptid esetében a rendezett
térszerkezet felvételére való hajlam erõs.
A peptidek közül rendezettségét tekintve kiemelkedik
a H-18QPLTSSER25-NH2 és a H-27DKQIRYIL34-NH2.
Érdemes megjegyezni, hogy a H-27DKQIRYIL34-NH2
peptid nagyfokú rendezettségét TFE/víz 1:1
(V/V)
elegyben is megtartja. A 17-46 régiót lefedõ
H-17RQPLTSSERIDKQIRYILDGISALRKETSN25-NH2
peptid, valamint az N-terminálison 9 aminosavval rövidített
változat és a H-36GISALRKETSN46-NH2
peptidek spektruma TFE-ben szintén rendezett szerkezeti elemek jelenlétét
mutatta. A TFE/víz 1:1 (V/V) oldószerkeverékben a
21 és 30 aminosavtagszámú peptidek megõrzik
a rendezett (feltételezhetõen helikális) másodlagos
szerkezetüket. Víz hozzáadása következtében
a H-36GISALRKETSN46-NH2 peptid spektrumában
a helikális jelleg eltûnik, de valószínûsíthetõ
a kanyar konformerek elõfordulása. Az aminosavcseréket
tartalmazó peptidek esetében a natív szekvenciájú
peptidekhez képest a H-27DKQIR32DIL34-NH2,
H-30IRYIL35YGI37-NH2 peptideknél
a rendezetlen másodlagos szerkezeti elemek jelenlétének
növekedését tapasztaltam.
A C-terminális peptidek (168-185 szakasz) CD spektruma
a rendezett (feltételezhetõen helikális) másodlagos
szerkezeti elemek jelenlétét mutatta. Az N-terminális
3 aminosav hiánya még nem befolyásolja jelentõs
mértékben a peptid hélix-képzési hajlamát
(H-171FKEFLQSSLRALRQM185-NH2). Ugyanakkor
6 aminosavrész (H-174FLQSSLRALRQM185-NH2)
vagy a C-terminális 3 aminosav eltávolítása
(H-168LRSFKEFLQSSLRAL182-NH2) már
nagymértékben rontotta a rendezett másodlagos szerkezet
kialakulásának lehetõségét.
Az IL-6R peptidek konformációja
A két triptofánt tartalmazó peptidek esetében
szinte azonos lefutású - bizonyos mértékû
rendezettségre utaló - CD görbéket kaptam TFE-ben
és TFE/víz 1:1 (V/V) elegyben. Ez valószínûleg
a két indolgyûrû kölcsönhatása miatt
jön létre, hiszen a peptidek mindössze 5-7 aminosavból
állnak. A peptidek spektrumából látszik, hogy
a konformerelegyben a rendezetlen (aperiodikus) elemek is jelen vannak.
Érdekes megjegyezni azt, hogy a konformerelegyek öszetétele
nem változott meg víz hozzáadása következtében
sem.

1. ábra. A kutatás gondolatmenete és célkitûzései
A peptidek biológiai hatása
Az IL-6 peptidek hatása HepG2 sejtek fibrinogén termelésére
Az N-terminális és C-terminális peptideket a fibrinogén szintézisre gyakorolt hatás szempontjából a következõ csoportokra oszthatom: azok a peptidek, amelyek önmagukban csökkentették a fibrinogén szintjét a sejtek felülúszójában; amelyek növelték; valamint amelyek ebben a kísérletben hatástalannak bizonyultak. A H-21TSSERIDK28-NH2 és a H-27DKQIRYIL34-NH2 peptid mind önmagában, mind rhIL-6 jelenlétében csökkentette a fibrinogén mennyiségét a sejtek felülúszójában. Mivel a peptidek nemcsak rhIL-6 jelenlétében, hanem önmagukban is csökkentették a fibrinogén mennyiségét, felmerülhet a gyanú, hogy ez a hatásuk nem az IL-6R komplexen keresztül érvényesül. Ennek tisztázása érdekében további vizsgálatok szükségesek. Az aminosavcseréket tartalmazó peptidek hatástalanok, ez azt mutatja, hogy a 32Tyr aminosav jelenléte fontos. A 45. és 46. pozicióban lévõ aminosavak felcserélése szintén megszünteti a peptid hatását. A C-terminális peptidek esetében az adatok azt mutatják, hogy a 171-182 szakasz jelenléte lényeges a hatás szempontjából.
A mindkét típusú (peptid, peptid + IL-6) kezelés során serkentõ hatást mutató peptidek esetében elõfordulhat receptorkötõdés, hiszen hatásuk - bár kismértékben - "IL-6-szerû. Az önmagukban hatástalan, kombinált kezelésekben gátló peptidek hatásának egy lehetséges magyarázata az lehet, hogy ezek a peptidek (konformációjuk, aminosavtagszámuk, aminosavsorrendjük miatt) nem alkalmasak hatás kiváltására. Ugyanakkor a kombinált kezelésben mutatott gátló hatás szerint - ha kötõdnek is a receptorhoz - nem indítják be a jelátviteli folyamatot. Az önmagukban és rhIL-6 jelenlétében gátló peptideknél valószínûsíthetõ, hogy a kötõhely blokkolása miatt nem érvényesülhet a rhIL-6 hatása a kombinált kezelések esetében.
Az IL-6 peptidek hatása HepG2 sejtek junB mRNS expressziójára
A hatást mutató peptidek szekvenciája a következõ:
N-terminális:
18QPLTSSER25
27DKQIRYIL34
26IDKQIRYILDGISALRKETSN46
36GISALRKETSN46
36GISALRKE43
C-terminális:
168LRSFKEFLQSSLRAL182
171FKEFLQSSLRALRQM185
174FLQSSLRALRQM185
179LRALRQM185
179LRALRQ184
A peptidek önmagukban serkentették, rhIL-6 jelenlétében azonban gátolták, vagy nem befolyásolták a junB mRNS expresszióját. Ezek az adatok azt jelenthetik, hogy a peptidek képesek a receptorhoz, vagy annak egy részéhez kötõdni. Valamilyen mértékben kiváltják a jelátviteli folyamatot, viszont affinitásuk elég nagy ahhoz (lásd kombinált kezelések), hogy a rhIL-6 ne tudja a peptideket leszorítani a kötõhelyrõl. Az adatok alapján a H-17QPLTSSER24-NH2, H-27DKQIRYIL34-NH2 és H-179LRALRQ184-NH2 peptidek affinitása a legnagyobb, ezek önmagukban és a kombinált kezelésekben ugyanolyan mértékû hatást mutatnak.
Egyes peptideknél (H-26IDKQIRYILDGISALRKETSN46-NH2, H-179LRALRQM185-NH2 és H-168LRSFKEFLQSSLRAL182-NH2) a kombinált kezelések során nagyobb génexpresszió értéket kaptam, mint amit a peptidek önmagukban képesek voltak indukálni. Ez azt jelezheti, hogy ezen peptidek affinitása a kötõhelyhez (vagy annak egy részéhez), kisebb, mint a rhIL-6 affinitása; a peptid a kötõhelyrõl részben leszorítható és a rhIL-6 hatása valamilyen mértékben érvényesül. Más peptidek (H-171FKEFLQSSLRALRQM185-NH2, H-36GISALRKE43-NH2) bár önmagukban serkentették a génexpresszió mértékét a kombinált kezelésekben nem befolyásolták a rhIL-6 hatását.
Az aminosavcseréket tartalmazó peptidek nem befolyásolták sem önmagukban, sem a kombinált kezelések esetében a génexpressziót. Ez ismét megerõsíti a 32Tyr aminosav és a 45. és 46. pozicióban lévõ aminosavak relatív helyzetének fontosságát.
Az IL-6Ra peptidek és a WSEWS-specifikus monoklonális ellenanyagok hatása HepG2 sejtek fibrinogén termelésére és a junB mRNS expressziójára
A "WSEWS-családba" tartozó peptidek a H-284WSEWS288-NH2 kivételével, nem befolyásolták a HepG2 sejtek fibrinogén szintézisét a vizsgált koncentráció tartományban rhIL-6 jelenlétében sem. Hasonló megfigyeléseket tettem a junB mRNS expressziójára vonatkozóan is.
A monoklonális ellenanyagok közül egy önmagában, és rhIL-6 jelenlétében is serkentette a fibrinogén szintézisét. Ez a megfigyelés azt jelzi, hogy a jelátvitel befolyásolható WSEWS-specifikus ellenanyaggal.
Kísérleteim bizonyították, hogy a szintetikus peptidek, fluoreszcens-peptidszármazékok és peptid-specifikus monoklonális ellenanyagok felhasználásával új információkat kaphatunk az IL-6 szerkezet-hatás összefüggések feltárásához.
Köszönöm Dr. Hudecz Ferenc tudományos tanácsadónak,
munkám témavezetõjeként nyújtott értékes
és útmutató tanácsait, türelmét,
észrevételeit, amelyekkel segítségemre volt
a téma kidolgozásában és a dolgozat elkészítésében.
Köszönöm Dr. Falus András egyetemi tanárnak
(SOTE Genetikai, Sejt- és Immunbiológiai Intézet igazgatójának)
és munkatársainak az együttmûködést.
Köszönöm Dr. Szekerke Máriának, hogy figyelemmel
kísérte és segítette munkámat. Köszönöm
az ELTE II. Peregrinatio Alapítvány, a TEMPUS 21-13 Joint
European Project, az OTKA (T 021120) támogatását.
Köszönöm a Soros Alapítványnak, hogy értekezésem
elkészítését támogatta.
Analysis of regions responsible for the activities of interleukin-6: the synthetic peptide approach
Ph. D. Thesis
Eötvös Loránd University, Budapest*
1999
Interleukin-6 (IL-6) is a multifunctional cytokine playing a pivotal role in immune and inflammatory responses. It exerts its activity through interaction with receptor complex, consisting of a ligand binding a- and a signal transducer b-chain. Based on experiments with point and deletion IL-6 mutants, the involvement of the N- and C-terminal parts of IL-6 in receptor binding were postulated. The aim of the present investigations was to study the role of these regions using the synthetic peptides approach. Three group of synthetic peptides corresponding to the 17-46 and 168-185 regions of the IL-6 and 282-288 part of the IL-6Ra were prepared by solid phase synthesis method. In addition, monoclonal antibodies specific for the IL-6Ra were developed. The solution conformation of these peptides was investigated, and studies were initiated to assess their IL-6 related biological properties.
Peptide synthesis The full length, the overlapping and truncated peptides corresponding to the 17-46 N-terminal region of the 185-residue isotype version of IL-6 were prepared by Fmoc or Boc strategy. Methionine-containing peptides derived from the 168-185 C-terminal region of IL-6 were synthesised either by Boc strategy applying N2 atmosphere or by Fmoc/tBu side chain protection scheme on the MBHA resin. The tryptophan-containing 282-288 IL-6Ra peptides were produced using both Boc and Fmoc strategies. The homogeneity of the RP-HPLC purified new compounds was checked by analytical RP-HPLC and was found to be > 95-99%. The primary structure of peptides were verified by amino acid analysis, FAB-MS and/or PD-MS.
Solution conformation of peptides were studied by CD spectroscopy in solution. These results showed that both 17-46 and 168-185 peptides are able to adopt markedly ordered conformation under appropriate conditions. The CD curves demonstrated that even relatively small linear oligopeptides preserved some tendency to form periodic conformation in TFE, however, there are marked differences in the type of secondary structures formed.
Synthesis and application of fluorescent derivatives of IL-6 peptides: 4-ethoxymethylene-2-[1]-naphtyl-5(4H)-oxazolone (naOx-OEt) labelled peptides were prepared by coupling naOx-OEt with semiprotected peptides attached to solid support or with unprotected peptides in solution. The naOx-peptides were used for binding studies. The interaction between soluble IL-6Ra and labelled peptides were monitored by fluorescence spectroscopy. Data showed that the fluorescence properties of the naOx-peptides can be efficiently used for detection of receptor binding.
Anti-WSEWS monoclonal antibodies: Using H-WSEWS-NH2 peptide-AK and -BSA conjugates, IgG type WSEWS-specific antibodies were developed and one of them was capable to modulate junB gene expression and fibrinogen synthesis on HepG2 cells.
The biological effect of synthetic peptides on HepG2 cells N- and C-terminal peptides induced changes in fibrinogen production and junB gene expression of human hepatoma cells in the absence or in the presence of recombinant human IL-6 (rhIL-6). Production of the fibrinogen was monitored by ELISA, while mRNA expression of junB was detected by competitive RT-PCR.
The effect of peptides and rhIL-6 on MDA MB 435 cells: Treatment
was develop to investigate the effect of rhIL-6 and synthetic peptides
on MDA MB 435 human breast cancer cells. Two N-terminal peptides have cytostatic
effect on these cells.
Publications
1. Bõsze Sz., Mák M., Medzihradszky-Schweiger
H., Hudecz F.: Chromatographic characterization of HSV1-gD 268-284 and
IL-6 179-185 synthetic oligopeptides by reversed-phase high performance
liquid chromatography, automated Edman degradation and mass-spectrometric
analysis.
J.Chromatog. A 668 (1994) 345-351.
2. Hudecz, F., Hilbert, ç., Mezõ, G., Mucsi, I., Kajtár,
J. Bõsze, Sz., Kurucz, I. Rajnavölgyi, É.: The
use of branched polypeptide carrier based conjugates for the design of
synthetic vaccine against HSV infection. In: Innovation and Perspectives
in Solid Phase Synthesis - Peptides, Polypeptides and Oligonucleotides
- 1994 (Ed. Epton, R.) 1994, Intercept, Andover pp.315-320.
3. Bíró J., Bõsze Sz., Hudecz F., Nagy
Z., Rajnavölgyi É., Schmidt B., Rákász É.,
Falus A.: The effect of WSEWS pentapeptide and WSEWS-specific monoclonal
antibodies on constitutive and IL-6 induced acute phase protein production
by human hepatoma cell line, HepG2. Immunology Letters46
(1995) 183-187.
4. Mezõ, G., Mák, M., Bõsze, Sz., Hudecz,
F.: Application of different protecting groups and cleavage methods in
the synthesis of peptide epitopes of Herpes simplex virus (HSV) glycoprotein
D. In: Peptides 1994 Proc. 23nd European Peptide Symposium, (Ed.:
H.L.S. Maia) 1995, ESCOM, Leiden, pp. 299-300.
5. Bõsze Sz., Bíró J., Falus A., Hudecz
F.: The effect of synthetic peptides corresponding to the WSEWS domain
on production of the acute phase proteins. Perspectives on Protein Engineering
& Complementary Technologies. (Geisow, M.J. and Epton, R., eds.)
Mayflower Worldwide, Birmingham (1995) 239-242.
6. Kóczán Gy., Bõsze Sz., Hudecz F.: Synthesis
and application of naphthyl-oxazolone derivatives of amino acids. Amino
Acids 9 (1995) 70.
7. Tóth S., Bõsze Sz.: Different action of LIF
and IL-6 on parental and metastatic breast cancer cells. Int. Medical
J. Exp. Clin. Res. Medical Science Monitor 2 (1996) Suppl.3
19-20.
8. Bõsze Sz., Igaz P., Takács K, Szabó
R., Tobisch Zs., Tóth S., Falus A., Hudecz, F.: Modulation of junB
mRNA expression and of acute phase response of HepG2 cells by WSXWS motif
related peptides and monoclonal antibodies. The Immunologist S1,
516, 1998.
9. Bõsze, Sz., Kajtár, J., Szabó, R., Falus,
A., Hudecz, F. Synthesis, solution conformation and interleukin-6 activities
of interleukin-6 peptides
J. Pep. Res. 52 216-228. (1998)
10. Bõsze, Sz., Igaz, P., Szabó, R., Tobisch,
Zs., Tóth, S., Falus, A., Hudecz, F.: Interleukin-6 peptides modulate
the production of acute phase proteins and the expression of junb protooncogen
on HepG2 cells. In: Peptides 1998. Proc. 25th European Peptide
Symposium, (Ed.: Bajusz, S., Hudecz, F.) 1999, Akadémiai Kiadó,
pp. 568-569.
11. Bõsze, Sz., Kóczán, Gy., Csik, G.,
Falus, A., Hudecz, F.: A New Fluorophore for peptide labelling: synthesis
and analysis of its interaction with Interleukin-6 receptor. In: Innovation
and Perspectives in Solid Phase Synthesis & Combinatorial Libraries,
1998 (Ed. Epton, R.) Mayflower Ltd, Birmingham, UK (1999), pp 189-192.
| Vissza a tartalomjegyzékhez
Back to Contents |
http://www.kfki.hu/chemonet/
http://www.chemonet.hu/ |