Uray Katalin
Mucin fehérjék epitópszerkezetének vizsgálata szintetikus peptidek és mucinspecifikus monoklonális ellenanyagok felhasználásával
ELTE-MTA Peptidkémiai Kutatócsoport, Budapest
1997
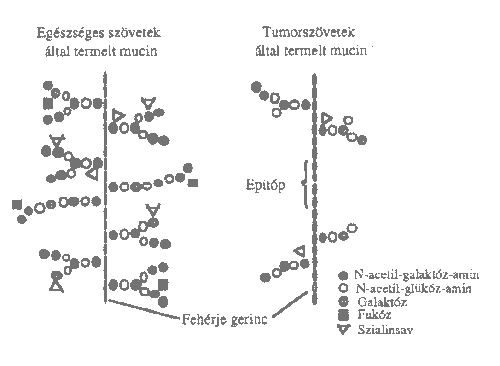
A nagymolekulatömegû mucin glikoproteinek rosszindulatú megbetegedések esetén rendellenesen glikozilálódnak, a szénhidrát-oldalláncok rövidebbek és ritkábban helyezkednek el. Ennek következtében a fehérjegerinc hozzáférhetõvé válik fehérjespecifikus ellenanyagok számára, ami lehetõvé teszi, hogy az egészséges és tumoros szövetek által termelt mucin glikoproteinek között kémiai – immunológiai különbséget tegyünk.
A mucin glikoproteinek nagyrészt ismétlõdõ szakaszokból épülnek fel, melynek szekvenciája a MUC2 glikoprotein esetében 1PTTTPITTTTTVTPTPTPTGTQT23.
Kutatásaim közvetlen célja az emlõ- illetve vastagbélcarcinomával összefüggõ MUC2 glikoproteinek ismétlõdõ szakasza epitópszerkezetének felderítése volt, a fehérjespecifikus 994 és 996 ellenanyagok által felismert peptid-epitópokat kerestem.

A MUC2 glikoprotein ismétlõdõ régióiból származó peptideket, a szilárdfázisú peptidszintézis módszerével, polisztirol alapú gyantán, Fmoc/tBu szintézis stratégia felhasználásával készítettem el
Polietilén tûkön mint hordozókon átlapoló heptapeptideket szintetizáltunk, melyek lefedték a MUC2 glikoprotein ismétlõdõ szakaszát. Ezeket a peptideket nem hasítottuk le a hordozóról.
A MUC2 glikoprotein ismétlõdõ szakaszán belül Chou és Fasman féle predikciós módszerrel jósoltam egyes térszerkezeti elemek jelenlétét.
A MUC2 peptidek térszerkezetét cirkuláris dikroizmus és Fourier transzformációs infravörös spektroszkópiai módszerekkel vizsgáltam. Oldószerként a rendezett térszerkezet kialakulását elõsegítõ trifluor-etanolt használtam, a CD spektroszkópiai méréseket TFE:víz elegyben és vízben is megvalósítottam.
A szintetikus mucin peptidekkel és a monoklonális ellenanyagokkal (994, 996) gátlási RIA kísérletet végeztem, amelynek során azt vizsgáltam, hogy milyen mértékben gátolják a különbözõ koncentrációjú oldott peptidek a 125I izotóppal jelzett ellenanyagok kötõdését szintetikus antigénekhez. A gátlás alapján vontam le következtetést a peptid-ellenanyag kötõdés specificitására és erõsségére.
A BSA makromolekulás hordozókhoz kapcsolt, illetve polietilén tûk hegyén szintetizált, azokról le nem hasított átlapoló peptidekkel és a megfelelõ ellenanyagokkal (994 és 996) ELISA kísérleteket végeztem, hogy közvetlenül vizsgáljam az ellenanyagok kötõdését ezen peptidekhez.
A MUC2 peptidek térszerkezete
Chou és Fasman predikció segítségével jósoltam a MUC2 glikoprotein ismétlõdõ szakaszának térszerkezetét, valamint cirkuláris dikroizmus és Fourier-transzformációs infravörös spektroszkópiás mérések segítségével vizsgáltam a peptidek oldatbeli térszerkezetét és ennek oldószer-függését.
A predikciós számítások szerint a következõ sorrend szerint valószínû az egyes tetrapeptid-szakaszok esetén a b-kanyar szerkezet kialakulása: 17TPTG20 > 18PTGT21 > 23TPTT26 > 13TPTP16 vagy 15TPTP18.
CD és FT-IR spektroszkópiás mérések alapján megállapítottam, hogy a 13TPTPTPTGTQTPTT26 szakaszon belül meghatározó szerepet játszik a b-kanyar szerkezetet felvevõ N-terminális 13TPTPT17, illetve 15TPTPT19 szakasz. Az eme szakaszt tartalmazó peptidek mind a CD, mind az FT-IR spektroszkópia alapján erõsen rendezett térszerkezetet vesznek fel trifluor-etanolban. Ezen peptidek közül is kiemelkedik a 15TPTPTGTQ22 peptid, amely a CD spektrumok alapján még TFE-víz 1:1 arányú keverékében is megõrzi nagyfokú rendezettségét, és az FT-IR spektrumban is kisebb a rendezetlen térszerkezeti elemek hozzájárulása, mint a 13TPTPTPTGTQTPTT26 vagy a 13TPTPT17 peptidek esetében.
Noha a 13TPTPTPTGTQTPTT26 régió C-terminális 22QTPTT26 pentapeptid szakasza önmagában erõs rendezettséget mutat TFE-ban, az ezt a szakaszt tartalmazó peptidek szerkezetére ez nincs számottevõ befolyással, a 16PTPTGTQTPTT26, 17TPTGTQTPTT26 vagy 19TGTQTPTT26 peptidek térszerkezete csak kismértékben rendezett.
Amennyiben a nagymértékben rendezett 15TPTPTGTQ22 peptidet N-terminálisán két aminosavval rövidítjük, a kapott 17TPTGTQ22 peptid, amely már nem tartalmazza a TPTPT szakaszt, kisebb mértékû, de szintén b-kanyar rendezettséget mutat. További két aminosavval való rövidítés pedig (19TGTQ22) a rendezettség szinte teljes elvesztését vonja maga után. A Pro N-terminálisú peptidek más térszerkezetet részesítenek elõnyben, mint a Thr terminálisúak. A 16PTPTGTQ22 és 18PTGTQ22 peptidek II típusú, a 15TPTPTGTQ22 és 17TPTGTQ22 peptidek I vagy III típusú b-kanyar szerkezetet vesznek fel trifluor-etanolban.
A 16PTPTGTQ22 peptid egyes aminosavainak D-aminosavakra cserélése kismértékben ugyan csökkenti a peptid rendezettségét, de a 16ptpTGTQ22 és a 16ptptGTQ22 peptidek is tartalmaznak b-kanyar struktúrát, amelynek kialakításában a D-aminosavak is résztvesznek.
A peptidek általában TFE-ban vettek fel rendezettebb szerkezetet, TFE:víz elegyben vagy vízben rendszerint erõsen csökkent a rendezettség. Kivételt képezett a 15TPTPTGTQ22 peptid, amely még TFE:víz elegyben is megõrizte rendezett szerkezetetét.
A kísérletek és számítások alapján összegezve megállapítottam, hogy a térszerkezet-vizsgálat eredményei összhangban vannak a Chou és Fasman féle, csak a primer szerkezeten alapuló módszerrel megjósolt térszerkezettel. A predikció alapján valószínûsített tetrapeptid-szekvenciákat tartalmazó szintetikus peptidek szerkezetében a kísérletek szerint valóban található b-kanyar szerkezeti elem.
Epitópok lokalizálása peptid–ellenanyag kölcsönhatás alapján
Az epitópok pontos helyének megismerése céljából szintetikus peptidekkel gátlási kísérleteket végeztem, melyeknek során a peptidek azon képességét vizsgáltam, hogy milyen mértékben gátolják a radioaktív jóddal jelzett 994 és 996 monoklonális ellenanyagok kötõdését a célantigénhez. A 996 ellenanyag esetében ezzel párhuzamosan epitóp térképezési ELISA kísérletet is végeztünk polietilén tûkön szintetizált átlapoló heptapeptideken.
A polietilén tûk hegyéhez kapcsolt, acetilezett peptidek közül a 16PTPTGTQ22, 17TPTGTQT23, 18PTGTQTP24 és 19TGTQTPT25 peptidekhez kötõdött a 996 ellenanyag. Ebbõl arra következtettünk, hogy a minimális epitóp a 19TGTQ22 szakasz.
A 996 ellenanyaggal végzett gátlási vizsgálatok során kimutattam, hogy csak azok a peptidek gátolták a 996 ellenanyag kötõdését, amelyek tartalmazták a 18PTGTQ22 pentapeptid szekvenciát, tehát oldatban ez a legkisebb aktív epitóp. A legerõsebb gátlást a 15TPTPTGTQ22 és 16PTPTGTQ22 peptidek esetében észleltem, míg a 18PTGTQ22 epitóp gyengén, de detektálhatóan gátolta a 996 ellenanyag kötõdését. Az optimális ellenanyag-felismeréshez tehát minimálisan a 16PTPTGTQ22 peptidre van szükség.
Oldatban a 19TGTQ22 tetrapeptidet a 996 ellenanyag nem ismerte fel. A D-aminosavakat tartalmazó peptidek közül a 16ptpTGTQ22 gátolta az ellenanyag kötõdését a célantigénhez, míg a 16ptptGTQ22 peptid ellenanyag gátlási képessége szinte elhanyagolható mértékû volt.
Megállapítottam, hogy a 996 ellenanyag által oldatban felismert legkisebb peptid a 18PTGTQ22, ezzel szemben a tûhegyen (szilárd felszínhez kötött állapotban) a 19TGTQ22 peptid bizonyult minimális epitópnak. Az optimális ellenanyag-felismeréshez ezzel szemben a 16PTPTGTQ22 peptidre van szükség. A 994 ellenanyag, a 996 ellenanyaggal ellentétben, nem egy meghatározott epitópot ismer fel, hanem a TX1TX2T motívumot, ahol X1 = Q, P vagy G; X2 = P vagy Q. Noha legerõsebben a 21TQTPT25 peptidhez kötõdik az ellenanyag, jelentõs mértékben felismeri a 13TPTPT17 és 19TGTQT23 peptideket is.
A Thr[26] aminosav-rész jelenléte erõsen gátolja a 994 ellenanyag-felismerést. Az ellenanyag ugyan kötõdik minden, a 21TQTPT25 szakaszt tartalmazó peptidhez, de amennyiben ez az aminosav is jelen van a peptidben, a peptid – ellenanyag kölcsönhatás három nagyságrenddel gyengül.
A térszerkezet szerepe az ellenanyag-felismerésben
A peptidek oldatbeli térszerkezetét a kötõdési kísérletekkel összevetve megállapítottam, hogy a 996 ellenanyag által felismert epitóp N-terminálisán elhelyezkedõ peptidszakasz rövidülésével párhuzamosan csökken a peptidek ellenanyag gátlási képessége és térszerkezetük rendezettsége, végül a 19TGTQ22 peptid esetében megszûnik. Leghatékonyabban a legrendezettebb térszerkezetû 15TPTPTGTQ22 peptidhez kötõdött a 996 ellenanyag.
Érdekes módon az azonosított b-kanyarok típusbeli különbsége nem befolyásolta a kötõdés erõsségét. Az I vagy III típusú kanyart tartalmazó 15TPTPTGTQ22 és a II kanyart tartalmazó 16PTPTGTQ22 azonos mértékben, igen erõsen gátolták a 996 ellenanyag kötõdését.
A 16PTPTGTQ22 peptidben a D-aminosavakkal történõ helyettesítés csak kismértékben változtatott a térszerkezet rendezettségén, továbbra is b-kanyar jelenléte figyelhetõ meg, ugyanakkor ellenanyag gátlási képességük igen gyenge volt.
A fenti eredményekbõl arra a következtetésre jutottam, hogy az optimális oldatbeli 996 ellenanyag-felismeréshez L-aminosavakból álló b-kanyar szerkezetre van szükség a 18PTGTQ22 epitóp N-terminálisán.
A 994 ellenanyag által felismert epitópnak a TXTXT motívum tekinthetõ. Az ilyen felépítésû szakaszt tartalmazó peptidek közül a rendezetlen térszerkezetû 21TQTPT25 és 17TPTGTQTPT25 peptideket ismeri fel leghatékonyabban az ellenanyag, majd a szintén rendezetlen 19TGTQT23 peptidet. Ezeknél kevésbé, de a többi peptidnél erõsebben kötõdik az erõsen rendezett szerkezetû 13TPTPT17 peptidhez is.
A Thr[26] hatására a peptidekben a 994 ellenanyag-felismerést megnehezítõ térszerkezet alakul ki, erre utal, hogy az ellenanyag erõsen kötõdik a rendezetlen 21TQTPT25 peptidhez, míg a nem kötõdõ 22QTPTT26 térszerkezete nagyfokú rendezettséget mutat. A Thr[26]-ot tartalmazó peptideket minden esetben több nagyságrenddel gyengébben ismeri fel a 994 ellenanyag, mint a 21TQTPT25 és 17TPTGTQTPT25 peptideket.
A 994 monoklonális ellenanyag által felismert peptidszakasz térszerkezetének pontosabb megismeréséhez további vizsgálatokra van szükség.
Gyakorlati felhasználás lehetõsége
Munkám során meghatároztam a 996 MUC2 specifikus ellenanyag által felismert legkisebb aktív peptid-epitópot. E peptid önmagában vagy megfelelõ makromolekulás hordozóhoz való konjugálás után alkalmas lehet:
Új, a 996 ellenanyagnál hatékonyabb, szelektívebb ellenanyag elõállítására. Az új ellenanyagot a vastagbél rosszindulatú elváltozásának korai kimutatására, valamint a betegség lefolyásának, a terápia hatásosságának követésére lehet használni. Az ellenanyaghoz radioaktív izotópot vagy tumorgátlószert lehet kapcsolni, és ezzel az immunkonjugátummal célzott immunterápia végezhetõ.
A megfelelõ makromolekulás hozdozóhoz kapcsolt immunogén peptid felhasználható lehet szintetikus oltóanyagként tumorellenes aktív specifikus immunterápiában (ASI).
Analysis of the epitope structure of mucin glycoproteins with synthetic peptides and mucin specific monoclonal antibodies
Ph. D. Thesis, Eötvös Loránd University, Budapest
1997
The high molecular weight mucin glycoproteins consist of variable number of tandem units. The repetitive sequence of MUC2 glycoprotein is 1PTTTPITTTTTVTPTPTPTGTQT23. The MUC2 mucin glycoprotein is expressed differently in case of malignant diseases (e.g. tumours of the colon), being overproduced and/or underglycosylated. Therefore in mucins originated from malignant tissues the protein backbone of the glycoprotein is more exposed to protein specific antibodies (Figure 1). Consequently, these structural and immunological differences can be utilised as tumour markers.
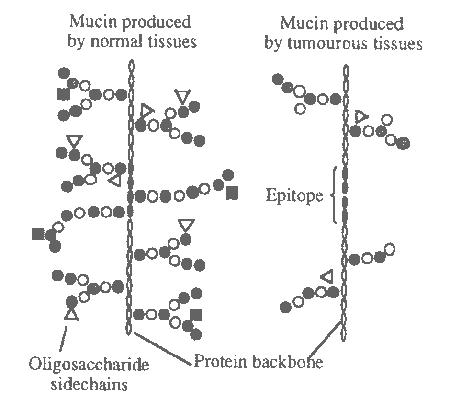
Figure 1
The aim of my studies was to discover the epitope structure of the MUC2 glycoprotein related to colon carcinoma using synthetic peptides and two mucin-specific monoclonal antibodies (994 and 996).
For this, I have prepared 26 synthetic peptides corresponding to the most hydrophilic, therefore potentially antigenic part of the tandem repeat unit of the MUC2 glycoprotein. Peptides corresponding to the 13TPTPTPTGTQTPTT26 region were prepared by solid phase peptide synthesis method, using Fmoc/tBu chemistry. For systematic studies C- and/or N-terminally truncated derivatives and D-amino acid substituted analogues were produced.
In addition, for the localisation of the epitope recognised by a MUC2 specific monoclonal antibody (996) overlapping heptapeptides covering the 1PTTTPITTTTTVTPTPTPTGTQT23 domain were synthesised on polyethylene pins, and the antibody binding to the peptides attached to the pins was tested in ELISA experiment. I have found that acetylated peptides containing the 19TGTQ22 sequence were recognised. In parallel experiments the ability of the synthetic MUC2 peptides to inhibit the antibody binding to target antigen in solution has been examined. Although the smallest peptide recognised in solution was the 18PTGTQ22 pentapeptide, the peptides with the strongest inhibiting ability were the 15TPTPTGTQ22 and 16PTPTGTQ22. D-amino acid substituted analogues of 16PTPTGTQ22, 16ptpTGTQ22 and 16ptptGTQ22 were also recognised by the same antibody, but the binding was less pronounced showing 100-1000 times higher IC50 values. Based on these observations I propose that the minimal epitope recognised by 996 monoclonal antibody is the 18PTGTQ22 pentapeptide, while the optimal epitope is 16PTPTGTQ22.
By Chou – Fasman prediction analysis of the secondary structure of the tandem repeat region I have found that 17TPTG20, 18PTGT21, 23TPTT26 and 13TPTP16 or 15TPTP18 tetrapeptide sequences had the higher probability to adopt b-turns. Essentially this was confirmed experimentally by circular dichroism (CD) and Fourier transformed infrared (FT-IR) spectroscopic studies in trifluoro-ethanol (TFE), water and TFE water mixture.
According to the spectra of the systematically truncated peptides, both the C- and N-terminal parts of the 13TPTPTPTGTQTPTT26 adopt ordered secondary structure. 13TPTPT17 sequence predominates the conformation of the whole region. The spectra of the central 15TPTPTGTQ22 sequence show the presence of b-turn. Truncation of this peptide on its N-terminus results in less ordered structure, until the completely disordered 19TGTQ22 peptide.
It should be noted that peptides containing Pro on their N-terminus behave differently from peptides with N-terminal Thr. While 15TPTPTGTQ22 and 17TPTGTQ22 peptides adopted type I or III b-turns, peptides 16PTPTGTQ22 and 18PTGTQ22 contain type II b-turns.
The inhibiting ability and solution conformation of the synthetic mucin peptides were also compared. I found that peptide 15TPTPTGTQ22 which adopts a highly ordered secondary structure inhibits the 996 binding more than an order of magnitude stronger than the less ordered 18PTGTQ22 peptide. On the other hand the type of b-turn (type I or III in case of 15TPTPTGTQ22 and 17TPTGTQ22 or type II b-turn in case of 16PTPTGTQ22 or 18PTGTQ22) has no significant influence on the immunorecognition. From these results I propose the following scheme for localised epitope in MUC2 tandem repeat (Figure 2). The minimal epitope of the 996 monoclonal antibody is the 18PTGTQ22 pentapeptide, but for optimal recognition a b-turn structural unit is required on its N-terminus. The MUC2 peptides were also tested for inhibiting the binding of the 994 monoclonal antibody to the same target antigen. In contrary with the 996 antibody recognising a short, well-defined sequence, the 994 antibody interacted with peptides containing the TXTXT motif. The antibody bound to the 21TQTPT25 the more strongly, but the 19TGTQT23 and 13TPTPT17 peptides were also recognised efficiently.
The results of these studies could be applied for 1) developing new, more selective antibodies applicable for a) early diagnosis of colon tumours and/or monitoring the efficiency of the treatment, b) targeted immunotherapy as carriers of antitumour drugs, 2) introduction of immunogenic peptides in active specific immunotherapy.
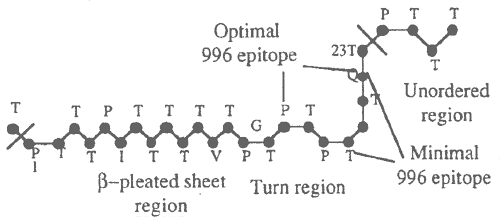
Figure 2
Publications
1. F. Hudecz, K. Uray, J. Kajtár, M.R. Price (1992) "Synthesis, Purification and CD Studies on Peptides Containing the Immunodominant Domain of an Epithelial Mucin Glycoprotein" in: Innovation and Perspectives in Solid Phase Peptide Synthesis, Peptides, Polypeptides and Oligonucleotides, 1992. Ed.: Epton, R. Intercept Limited, Andover, 1992. pp:329-332.
2. K. Uray, M.R. Price, L.G. Durrant, J. Kajtár, F. Hudecz (1993) The influence of epitope presentation on the immunorecognition of human colon carcinoma related mucin peptides. Biochemical Society Transactions 21, 324S.
3. M.R. Price, M. Sekowski, A. Ladányi, K. Uray, Y. Ma, L.G. Durrant, S.J.B. Tendler (1993) Immune Recognition of Human Colonic-Tumour-Associated MUC-2 Mucins Using an Anti-Peptide Antibody. Int. J. Cancer 55, 753-759.
4. K. Uray, M.R. Price, L.G. Durrant, J. Kajtár, F. Hudecz (1993) Synthesis, Conformation and Immunorecognition of human colon carcinoma related mucin peptides in: Peptides 1992 Ed.: Schneider, C.H. and Eberle, A.N. ESCOM Science Publ.,1993. pp. 871-872.
5. K. Uray, J. Kajtár, M.R.Price and F. Hudecz (1995) The role of primary and secondary structure in antibody recognition of a protein core epitope from the tandem repeat unit of MUC2 glycoprotein:the use of D-amino acid substituted flanks. in: Solid Phase Synthesis - Peptides, Polypeptides and Oligonucleotides - 1995, Ed.: Epton, R. Mayflower Worldwide, Birmingham, 1996. (in press)
| Vissza a tartalomjegyzékhez Back to Contents |
http://www.kfki.hu/chemonet/ http://www.ch.bme.hu/chemonet/ |