Mörtl Mária
Karbamidsav szililészterek elõállítása és reakciói
Eötvös Loránd Tudományegyetem, Budapest
1996
Eredmények összefoglalása
Elõállítottam korábban kidolgozott módszerekkel 13 új, nagy térigényû szubsztituenseket tartalmazó karbamidsav szililésztert, ebbõl hármat átszililezésel, tizet az ammóniumsóból trimetil-klórszilánnal. Eljárást dolgoztam ki a szililezett N-hidroxi-karbamidsav származékok elõállításá-ra, s így további 11 új vegyületet állítottam elõ.
Különbözõ nagymûszeres módszerekkel vizsgáltuk az elõállított vegyületeket. Az Me3SiONHCOO-tBu Röntgendiffrakciós vizsgálatából kitûnt, hogy ez a vegyület különbözik az N-alkil-karbamidsav észterektõl, a konjugáció kevésbé kiterjedt és a nitrogén körül nem planáris a szerkezet.
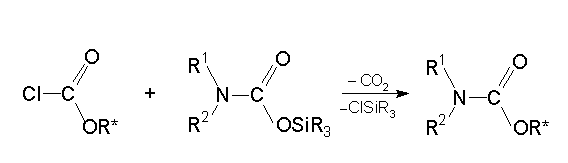
Vizsgáltam a karbamidsav szililészterek reakcióját klór-hangyasav észterekkel. Megállapítottam, hogy az átalakulás szén-dioxid kilépésével klórszilán képzõdése közben játszódik le és a megfelelõ N,N-dialkil-karbamidsav-alkil-észter keletkezik:

1. séma
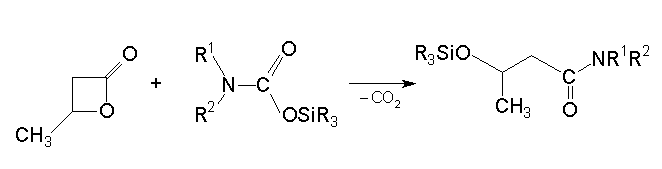
Vizsgáltam a karbamidsav szililészterek reakcióját butiro-laktonokkal. Megállapítottam, hogy az átalakulás során szén-dioxid és sziloxi-butánsav-amid képzõdik:
2. séma
A fenti reakciókkal kapcsolatban általános tapaszlatatként adódott, hogy nem megy végbe az átalakulás, ha:
- a szilíciumon nagy térigényû csoport van
- a nitrogénen nagy térigényû csoport van
- a nitrogén nem kötõ elektronpárja aromás gyûrû része
vagyis mind a nitrogén, mind a szilícium térgátoltsága akadályozza a reakciót. Ezen tapasztalatok alapján mindkét esetben egy olyan hattagú gyûrûs átmeneti állapot feltételezhetõ, melyben egyidejû nukleofil támadás éri a szilíciumot és a karbonil szenet:
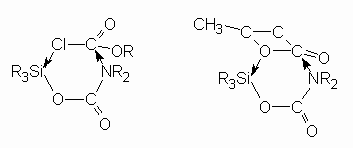
3. séma
Vizsgáltam az N-sziloxi-, ill. N-alkoxi-karbamidsav származékok termikus átalakulását. Megállapítottam, hogy ezen vegyületek közül az N-szilil-N-sziloxi-karbamidsav származékok a -eliminációval alkoxi-, ill. sziloxi-karbonil-nitrént szolgáltatnak, amely megfelelõ körülmények között (ionforrás hõmérséklete 300 oC, kémiai ionizáció) a tömegspektrométerben közvetlenül kimutatható.
Megállapítottam, hogy az N-alkoxi-, az N-alkil-N-sziloxi-,
ill. az N-sziloxi-karbamidsav észtereknél nem tapasztaható
bomlás 140-145 oC hõmérsékleten.
ß–eliminációt csak az
N-trimetil-szilil-N-trimetil-sziloxi-karbamidsav fenil-észternél
tapasztaltam, és szilanol, ill. alkohol eliminációjára
sem kerül sor.
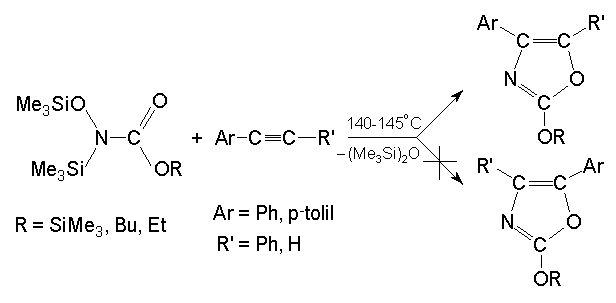
Csapdáztam az N-trimetil-sziloxi-N-trimetil-szilil-karbamidsav n-butil-, ill. trimetil-szililészter termikus bomlása során keletkezõ nitrént különbözõ gyökfogókkal. Megállapítottam, hogy ciklohexánnal C-H beékelõdéssel N-ciklohexil-karbamidsav észterek képzõdnek, acetilénnel pedig 1,3-dipoláris cikloaddícióban oxazol vegyületek keletkeznek. Ez az addíció irányítottan megy végbe, a karbonilnitrén gyök polaritása ellentétes a reakció centrumát képezõ atomok elektronegativitásából levezethetõ polaritással.
4. séma
Vizsgáltam a karbamidsav szililészterek, ill. a ditiokarbamidsav szililészterek reakcióját TiCl4·2THF komplexszel, valamint CpTiCl3-mal. Megállapítottam, hogy az átalakulás során klórszilán kilépése közben a megfelelõ vegyes ligandumú karbamidáto-kloro-titán komplexek képzõdnek. Módszert dolgoztam ki ilyen típusú vegyületek elõállítására és ezen az úton elõállítottam 11 új titán vegyületet.
Megállapítottam, hogy a titán karbamidáto komplexeinek elõállítására a karbamidsav szililészterek jó kiindulási anyagok, mert enyhe körülmények között jó termeléssel képzõdik a kiindulási vegyületek arányától függõen a kívánt termék. Három karbamidát ligandum nem kapcsolódhat a ciklopentadienil-titán részlethez, aminek térbeli okok mellett elektronszerkezeti oka is lehet, hiszen a titán esetében a 16 elektronos vegyületek a gyakoriak.
Preparation and reactions of silylcarbamates
Ph.D. thesis, Eötvös Loránd University, Budapest
1996
Preparation of silylcarbamates
Some new silylcarbamates with bulky substituents have been prepared in order to study their reactivity with nucleophilic agents as lactones and chloroformates. New N-siloxy- or N-alkoxy-carbamic acid derivatives have been also prepared. For the silylation hexamethyl-disilazane and/or trimethylchlorosilane in the presence of triethylamine were used depending on the structures of the desired carbamate. The thermal behaviour of these compounds was studied in the absence and presence of other reaction partners.
Reactions of silylcarbamates
1. Reactions with lactones and chloroformates
The studied reactions of silylcarbamates with nucleophilic reactants are accompanied by evolution of carbondioxide. The treatment of silylcarbamates with chloroformates gives trimethylchlorosilane and the corresponding N,N-dialkyl carbamate. . (See Scheme 1. in the Hungarian text)
The treatment of silylcarbamates with lactones yields the corresponding siloxy-butyramides. (See Scheme 2. in the Hungarian text)
The difference in the reactivity between the meta and para substituted N-aryl-O-trimethylsilyl carbamates and the steric effect of the substituent of the nitrogen was also studied. There is usually no reaction if a bulky substituent is bonded either to the silicon or to the nitrogen and when the nitrogen is member of an aromatic ring, respectively. On the basis of the results we can conclude that the nucleophilic attack on silicon and the bulkiness of the substituens play an important role. A six-member-ring transition state was suggested where a simultaneous nucleophilic attack takes place on the silicon and the carbonyl carbon atom. (See Scheme 3. in the Hungarian text)
2. Thermal reactions of N-hydroxy-carbamic acid derivatives
The decomposition of compounds leads - if a -elimination of hexamethyldisiloxane is possible - to the formation of a reactive intermediate (nitrene) of radical character which can be detected under appropriate circumstances (source temperature 300 oC, chemical ionization) by ms. ß–elimination was observed only in the case of N-trimethylsilyl-N-trimethylsiloxy-O-phenyl carbamate; the other compounds are stable. Elimination of mixed alkyl-silyl-ether was not observed. This nitrene intermediate participates in further reactions in the presence of radical trapping agents in two different ways: the nitrogen as a reaction center can be inserted into a s (C-H) bond; the nitrogen and the oxygen as a double reaction center can be added to a p -bond.
The latter cycloaddition is regiospecific. In the carboxy-nitrene radical the nitrogen is more negative than the oxygen, so during the cycloaddition the nitrogen will be connected to the carbon of phenylacetylene bearing the phenyl group. . (See Scheme 4. in the Hungarian text)
Preparation of carbamato-titanium(IV) complexes
The silylcarbamates are suitable reagents for the preparation of the carbamato-chloro-titanium(IV) compounds. The reaction of tetrachlorobis(tetrahydrofuran)titanium(IV) with silylcarbamates gives mixed carbamato chloro complexes containing two molecules of THF. Cyclopentadienyltitanium trichloride reacts similarly. One or two chlorine can be exchanged for a carbamato group depending on the stoichiometry of the starting materials, but the third one can not be exchanged even with the excess of silylcarbamates. The carbamato group is bidentate ligand in these complexes. Some dithiocarbamato analogues were also prepared.
Publications
1. Mörtl M., Knausz D., Szakács L., Csákvári B.: Új karbamidsav-szililészterek szintézise és reakciói Kémiai Közlemények, 74 (1992) 139-146
2. M. Mörtl, D. Knausz, Zs Kolos, L. Szakács, B. Csákvári: Synthesis and reactions of silylcarbamates with bulky substituents J. Organometallic Chemistry, 482, (1994) 183-185
3. M. Mörtl, D. Knausz, Zs. Böcskei, Zs. Kolos, K. Újszászy L. Szakács, P. Sohár: New N-hydroxy carbamic acid trial- kylsilyl derivatives. Preparation and thermal reaction. J. Organometallic Chemistry, 492, (1995) 115-119
| Vissza a tartalomjegyzékhez Back to Contents |
http://www.kfki.hu/chemonet/ http://www.ch.bme.hu/chemonet/ |