Kotschy András
Szelektív átalakítások hídfõ-nitrogén tartalmú azóliumsókkal
Eötvös Loránd Tudományegyetem, Budapest
1995
Az értekezés tárgya: két és háromgyûrûs hídfõ-nitrogén tartalmú azóliumsók elõállítása, gyûrûfelnyílási reakcióinak vizsgálata és a gyûrûfelnyílási folyamatokban keletkezõ diének fordított elektronigényû Diels-Alder reakciójának vizsgálata.
Az eredmények összefoglalása
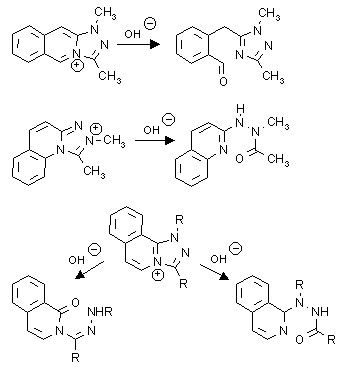
I. Többszörösen kondenzált azóliumsók gyûrûfelnyílása: modellként az [ 1,2,4] triazolo[ 4,3-a] piridinum rendszer háromgyûrûs analógjait választottuk, melyek elõállítására eljárásokat dolgoztunk ki. Az elõállított sókat tetrabutil-ammónium hidroxiddal reagáltatva azt tapasztaltuk, hogy a nukleofil támadási pontja - és ezáltal a rekció végterméke - függ mind az anellációtól, mind a triazolgyûrû szubsztituenseinek elhelyezkedésétõl és minõségétõl. A hídfõ-nitrogénnel szomszédos szénatomokon lejátszódó belépés eredményeként három eltérõ vegyülettípus képzõdését észleltük és az egyes reakciók szelektivitását értelmeztük.

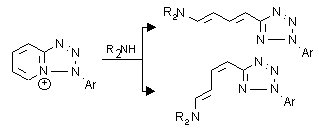
II. Kondenzált piridínium sók gyûrûfelnyílása: eljárásokat dolgoztunk ki a kétgyûrüs, 5+6 kondenzációs típusú azolo-piridínium valamint 6+6 kondenzációs típusú pirido-azínium rendszerek szekunder aminok hatására lejátszódó szelektív gyûrûfelnyílására. Az elöbbiek esetében morfolin hatására transz,transz geometriájú, míg 2-metil-aziridin esetében cisz,transz geometriájú diénaminok keletkeztek. A pirido-azínium sók esetében gyûrûfelnyílást csak pirrolidinnel sikerült kiváltanunk. Itt a szelektivitást a reakciókörülmények változtatásával értük el: a reakciót acetonitrilben folytatva cisz,transz diénaminokat, míg vizes etanolt használva transz,transz geometriájú termékeket izoláltunk.
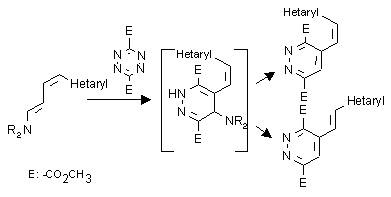
III. Hetaril-diének fordított elektronigényû Diels-Alder reakciói: 1,2,4,5-tetrazin-3,6-dikarbonsav dimetilésztert mint elektronhiányos diént azolil-diénaminokkal, mint elektrondús dienofilekkel reagáltatva azolilvinil-piridazinok képzõdédését észleltük, amelyekben a vinil oldallánc geometriája megegyezett a kiindulás diénaminok megfelelõ kettõskötésének geometriájával. Ugyanilyen irányú reaktivitást és az oldallánc geometriájának megõrzõdését észleltük a transz,transz azinil-diénaminok esetében is. A cisz,transz azinil-dién-aminok közül azonban csak a pirin analóg esetében izoláltunk cisz oldallánc-geometriájú terméket, míg a többi esetben a termék transz szerkezetû volt. Azon feltevésünket, hogy az izomerizációs lépés az átmeneti termékként keletkezõ dihidro-piridazin szerkezeten játszódik le, analóg tetrazolil-diének reakcióinak vizsgálatával támasztottuk alá.
Selective transformations of bridgehead nitrogen containing azolium salts
PhD thesis, Eötvös Loránd University, Budapest
1995
The topic of the thesis is the synthesis of bicyclic and tricyclic bridgehead nitrogen containing azolium salts, their ring opening with nucleophiles, and the "inverse electron demand" Diels-Alder reactions of the dienes formed in the ring opening reactions.
The summary of the results
I. Ring opening of policondensed azolium salts: synthetic procedures were developed for the synthesis of the tricyclic analogues of the [1,2,4]triazolo[4,3-a]pyridinium system which were selected as modell compounds. We found that in the reaction of the prepared salts with tetrabutyl-ammonium hydroxide the site of the attack of the nucleophile - and the course of the reaction - depended both on the anellation pattern and on the position and structure of the substituents on the triazol ring. As the hydroxide ion entered at one of the carbon atoms next to the bridgehead nitrogen three different kind of products were isolated and the selectivity of their formation was rationalised.
II. Ring opening of fused pyridinium salts: new procedures were developed for the selective ring opening of the 5+6 condensed azolopyridinium salts and the 6+6 condensed pyridoazinium salts with secondary amines. The reaction of the previous with morpholine gave dienamines with trans,trans geometry while with 2-methylaziridine resulted in dienamines with cis,trans geometry. In the case of the 6+6 condensed pyridoazinium salts the ring opening could only be achieved using pyrrolidine. Carrying out the reaction in acetonitrile cis,trans dienamines were isolated while in aqueous ethanol trans,trans dienamines were formed.
III. "Inverse electron demand" Diels-Alder reactions of hetaryldienes: in the reaction of the electron deficient diene system - dimethyl 1,2,4,5-tetrazine-3,6-dicarboxylate - with azolyl-dienamines as electron rich olefins azolylvinyl-pyridazines were formed in which the geometry of the sidechain was the same as the geometry of the appropriate double bond in the starting diene. The same reactivity and retention of the sidechain geometry was observed in the reaction of the trans,trans azinyl-dienamines. Of the cis,trans azinyl-dienamines only the pyridyl analogue gave cis product while the geometry of the sidechain in all the other products reversed to trans. The theory that the isomerisation occurs on a dihydropyridazine intermediate was supported by the study of the reactions of other tetrazolyl-dienes.
Publications
1. A. Kotschy, Gy. Hajós, A. Messmer, G. Jones, "Selective Ring Opening of Linearly and Angularly Fused Triazolium Salts" Tetrahedron, 52, 1399-1410 (1996)
2. Gy. Hajós, Zs. Riedl, G. Timári, A. Kotschy, M. Béres, T. Soós, A. Messmer, S. Bátori, W. Ritzberger, J. Schantl, " Fused Triazoles and Triazolium Salts with Bridgehead Nitrogen Atom. Novel Syntheses and Selective Transformations" Khimia Geterociklicseskih Soedinenii, 10, 1358-1366 (1995)
3. A. Kotschy, Gy. Hajós, A. Messmer, " Expected Selec- tivity and Unexpected Isomerisation in the Inverse Diels-Alder Reaction of Azolyl Dienes" Journal of Organic Chemistry, 60, 4919-4921 (1995)
4. A. Kotschy, Gy. Hajós, G. Timári, A. Messmer, "Synthesis of Azinylvinylpyridazines: A General Note on the Isomerization of Hetaryldienamines" Journal of Organic Chemistry, 61, 4423-4426 (1996)
| Vissza a tartalomjegyzékhez Back to Contents |
http://www.kfki.hu/chemonet/ http://www.ch.bme.hu/chemonet/ |