Hornyánszky Gábor
Sztereoszelektív szintézisek. HMG-KoA-reduktáz enzimrendszert gátló vegyületek szintézise. Új Hexythiazox analógok szintézise. Vizsgálatok a krizantémsav etilészter és a permetrinsav metilészter elõállítására
Budapesti Mûszaki Egyetem
1995
Kutatómunkám során elõször a koleszterin bioszintézisében kulcsszerepet játszó HMG-KoA-reduktáz enzimrendszert gátló vegyületek szintézisével foglalkoztam, az utóbbi években jó hatásúnak bizonyult származékokhoz hasonló szerkezetû, naftalin, dihidro-naftalin, tetrahidro-naftalin, kromán és indol vázat tartalmazó származékok elõállításával.
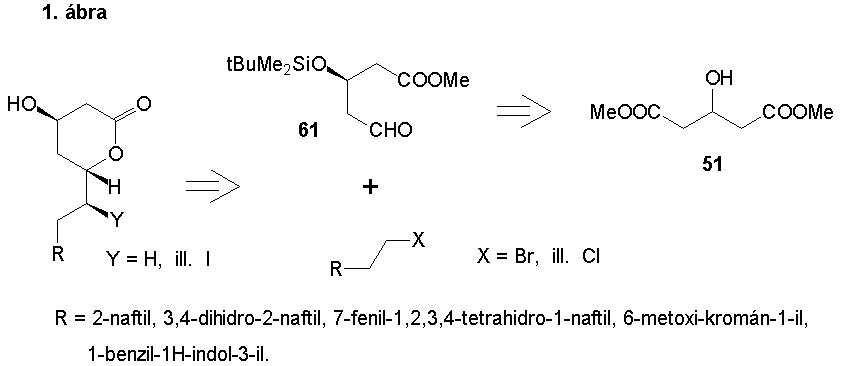
Szintéziseim stratégiájává a 1. ábrán feltüntetett reakcióutat választottam. E szerint a célvegyületek szintézisét konvergens szintézisúttal királis aldehid (61), illetve a megfelelõ halogénvegyületekbõl képzett Grignard-, illetve Wittig-reagensek összekapcsolásával; a királis aldehidet (61) prokirális 3-hidroxi-glutársav dimetilészterbõl (51) sztereoszelektív szintézissel kívántam elõállítani.

A királis aldehid (61) szintézisét prokirális 3-hidroxi-glutársav dimetilészterbõl (51) kiindulva sertésmáj-észteráz (PLE) enzimmel végzett sztereoszelektív hidrolízis segítségével valósítottam meg.
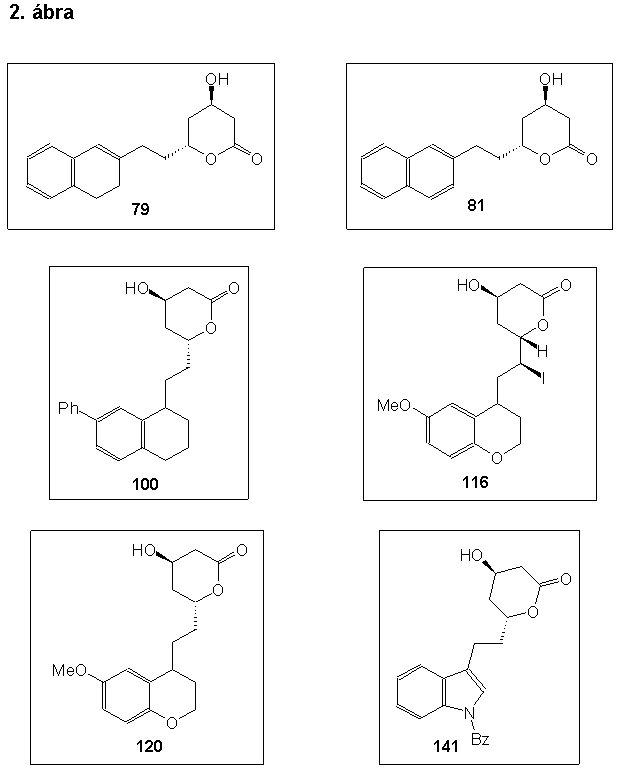
A naftalin, és a 3,4-dihidro-naftalin vázat tartalmazó vegyületek szintézisét 2-naftolból kiindulva, a megfelelõ Grignard-vegyület és a 61-es királis aldehid összekapcsolása által valósítottam meg. Kutatómunkám során sikeresen megoldottam a (4R,6R)-4-hidroxi-6-[2-(3,4-dihidro-2-naftil)-etil]-3,4,5,6-tetrahidro-2H-pirán-2-on (79) éa a (4R,6R)-4-hidroxi-6-[2-(2-naftil)-etil]-3,4,5,6-tetrahidro-2H-pirán-2-on (81) szintézisét.
A 7-fenil-1,2,3,4-tetrhidro-naftalin vázat tartalmazó vegyületek szintézisét bifenilbõl kiindulva, a megfelelõ Wittig-reagens és a 61-es királis aldehid összekapcsolásával, végül a laktongyûrû kialakítását jódlaktonizácíó segítségével valósítottam meg. Kutatómunkám során sikeresen megoldottam a (4R,6R,1íRS)-6-[2-(7-fenil-1,2,3,4-tetrahidro-1-naftil)-etil]-4-hidroxi-3,4,5,6-tetrahidro-2H-pirán-2-on (100) szintézisét.
A 6-metoxi-kromán vázat tartalmazó vegyületek szintézisét 4-metoxi-fenolból kiindulva, az elõzõ bekezdésben leírtakhoz hasonlóan hajtottam végre. Kutatómunkám során sikeresen megoldottam a (4R,6S,1íS,4"RS)-4-hidroxi-6-[1-jód-2-(6-metoxi-kromán-4-il)-etil]-3,4,5,6-tetrahidro-2H-pirán-2-on (116) és a (4R,6R,4íRS)-4-hidroxi-6-[2-(6-metoxi-kromán-4-il)-etil]-3,4,5,6-tetrahidro-2H-pirán-2-on (120) szintézisét.
Az 1-benzil-indol vázat tartalmazó vegyületek szintézisét b -3-indolil-ecetsavból kiindulva, az elõzõ bekezdéssel analóg módon valósítottam meg. Kutatómunkám során sikeresen megoldottam a (4R,6R)-6-[2-(1-benzil-1H-indol-3-il)-etil]-4-hidroxi-3,4,5,6-tetrahidro-2H-pirán-2-on (141) szintézisét.
Kutatómunkám második részében egy új, jó hatásúnak bizonyult atkaölõszer a Hexythiazox tiazolidin gyûrûjének 5-ös poziciójában metilcsoportal szubsztituált analógjait, valamint 5-metil-oxazolidin gyûrût tartalmazó származékait készítettem el.
E munka során elõállítottam a Hexythiazox következõ analógjait: transz-5-(4-klór-fenil)-4,5-dimetil-2-tio-oxazoli-din-3-karbonsav-fenilamid (171), transz-5-(4-klór-fenil)-4,5-dimetil-2-tio-oxazolidin-3-karbonsav-ciklohexilamid (172), cisz-5-(4-klór-fenil)-4,5-dimetil-2-tio-oxazolidin-3-karbonsav-fenilamid (173), cisz-5-(4-klór-fenil)-4,5-dimetil-2-tio-oxazolidin-3-karbonsav-ciklohexilamid (174), transz-5-(4-klór-fenil)-4,5-dimetil-2-oxo-tiazolidin-3-karbonsav-fenil-amid (175), transz-5-(4-klór-fenil)-4,5-dimetil-2-oxo-tiazoli-din-3-karbonsav-ciklohexilamid (176), transz-5-(4-klór-fenil)-4,5-dimetil-2-tio-tiazolidin-3-karbonsav-fenilamid (177), transz-5-(4-klór-fenil)-4,5-dimetil-2-tio-tiazolidin-3-karbonsav-ciklohexilamid (178) (3. ábra). A vegyületek az elsõ vizsgálatok alapján enyhébb hatást mutatnak, mint az alapvegyület.
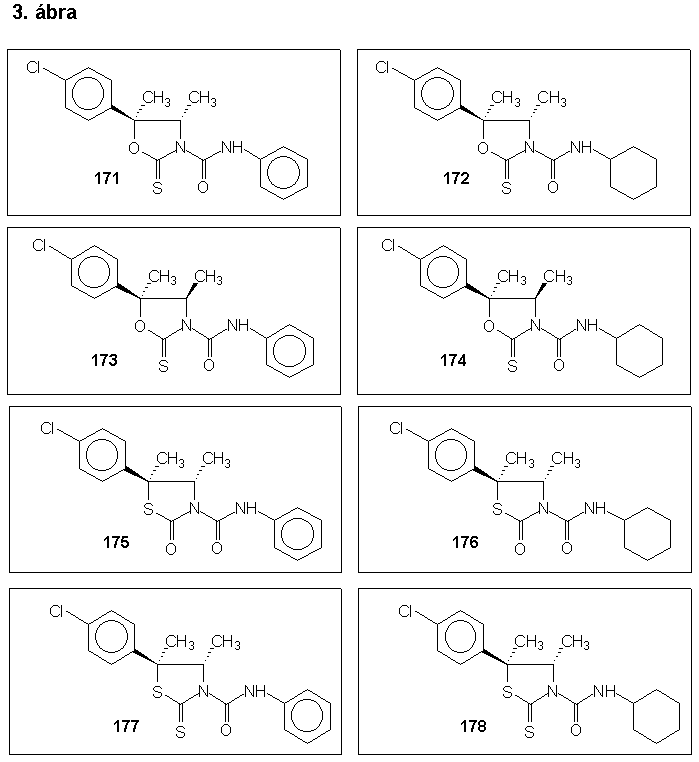
Kutatómunkám harmadik részében egy másik növényvédõszer-család a piretrinek szintézisében kulcsszerepet játszó krizantémsav etilészter és permetrinsav metilészter elõállításának körülményeit vizsgáltam, a kitermelés, a reakció sztereoszelektivitása, a reagensek aránya, valamint a katalizátor újrafelhasználása szempontjából.
Kutatómunkám során 17 királis, illetve akirális réztartalmú katalizátorral vizsgáltam a krizantémsav etilészter elõállítását. A vizsgálatok során néhány katalizátorral sikerült 90% feletti termelést elérni. A b -ciklodextrin-réz(II)-komplex alkalmazása esetén a katalizátor kiszûrhetõ, és a reakcióben többször újrafelhasználható a termelés számottevõ csökkenése nélkül.
A permetrinsav metilészter elõállításának vizsgálata során megállapítottam, hogy MoO3 és CuSO4 keverék-katalizátorral a reakció 76%-os termeléssel kivitelezhetõ, a katalizátor újrafelhasználható, és a reakcióban használt dién-diazoészter arány 4:1-rõl 2:1-re csökkenthetõ. A reakció végén a diénfelesleg jó eredménnyel visszanyerhetõ, a reakcióban csak kevés kátrányos melléktermék képzõdik.
STEREOSELECTIVE SYNTHESES
Ph.D. thesis, Technical University of Budapest
1995
In first part of my work I synthesized novel HMG-CoA reductase inhibitors, whichís structure is similar to the known and successful oneís. They are naphthalene, croman and indol analogs of Mevinolin.
The strategy of my synthesis is shown in Scheme 1.
During my work I successsfully prepared the following compounds: (4R,6R)-4-hydroxy-6-[2-(3,4-dihydro-2-naphth-yl)ethyl]-3,4,5,6-tetrahydro-2H-pyran-2-one (79), (4R,6R)-4-hydroxy-6-[2-(2-naphthyl)ethyl]-3,4,5,6-tetrahydro-2H-pyran-2-one (81), (4R,6R,1íRS)-4-hydroxy-6-[2-(1,2,3,4-tetrahydro-7-phenyl-1-naphthyl)ethyl]-3,4,5,6-tetra-hydro-2H-pyran-2-one (100), (4R,6S,1íS,4"RS)-4-hydroxy-6-[1-iodo-2-(6-methoxycroman-4-yl)ethyl]-3,4,5,6-tetrahydro-2H-pyran-2-one (116), (4R,6R,4íRS)-4-hydroxy-6-[2-(6-methoxycroman-4-yl)ethyl]-3,4,5,6-tetrahydro-2H-pyran-2-one (120), and (4R,6R)-6-[2-(1-benzyl-1H-indol-3-yl)ethyl]-4-hydroxy-3,4,5,6-tetrahydro-2H-pyran-2-one (141) (Scheme 2). These compounds inhibited moderately the HMG-CoA reductase.
In second part of my work I synthesized analogs of a new potent acaricide, name Hexythiazox. During my work I successfully prepared the 5-methyl-substituted and 5-methyl-oxazolidine-ring containing analogs of Hexythiazox. They are the following: trans-5-(4-chlorophenyl)-4,5-dimethyl-2-thioxooxazolidin-3-carboxylic acid phenylamide (171), trans-5-(4-chlorophenyl)-4,5-dimethyl-2-thioxo-oxazolidin-3-carboxylic acid cyclohexylamide (172), cis-5-(4-chlorophenyl)-4,5-dimethyl-2-thioxooxazolidin-3-carbox-ylic acid phenylamide (173), cis-5-(4-chlorophenyl)-4,5-di-methyl-2-thioxooxazolidin-3-carboxylic acid cyclohexyl-amide (174), trans-5-(4-chlorophenyl)-4,5-dimethyl-2-oxo-thiazolidin-3-carboxylic acid phenylamide (175), trans-5-(4-chlorophenyl)-4,5-dimethyl-2-oxothiazolidin-3-carboxylic acid cyclohexylamide (176), trans-5-(4-chlorophenyl)-4,5-dimethyl-2-thioxothiazolidin-3-carboxylic acid phenylamide (177), trans-5-(4-chlorophenyl)-4,5-dimethyl-2-thioxothia-zolidin-3-carboxylic acid cyclohexylamide (178) (Scheme 3).
In third part of my work I investigated the conditions of preparation of crysanthemic acid ethyl ester and permetrinic acid methyl ester, the key intermediates of an other insecticide-family, the pyretrines, from the following points of view: the yield, the stereoselectivity of the reaction, the ratio of reagents and reuse of catalist.
During my work I investigated the preparation of crysanthemic acid ethyl ester using 17 chiral or achiral copper-containing catalists. Using some of them I got the ester in very good yield (more than 90%). Using b -cyclodextrine-copper(II)-complex the catalist can be filtered and reused in this reaction without decrease of yield.
During the investigation of preparation of permetrinic acid methyl ester I established that using MoO3 and CuSO4 mixture-catalist the reaction can be carried out in good yield (76%), the catalist can be reused, and the ratio of diene-diazoester can be reduced from 4:1 to 2:1. After the reaction the excess of reagent can be recovered, and during the reaction only small amount of byproduct yields.
Publications
1. Lajos Novák, János Rohály, László Poppe, Gábor Hornyánszky, Pál Kolonits, István Zelei, Imre Fehér, Jenõ Fekete, Éva Szabó, Uwe Záhorszky, András Jávor and Csaba Szántay; Liebigs. Ann. Chem., 1992, 145-157
2. Lajos Novák, Gábor Hornyánszky, János Rohály, Pál Kolonits and Csaba Szántay Liebigs. Ann. Chem., 1995, 1877-1883
3. Lajos Novák, Gábor Hornyánszky, János Rohály, Pál Kolonits and Csaba Szántay Pesticide Science, in press (Received 17. October 1995.)
| Vissza a tartalomjegyzékhez Back to Contents |
http://www.kfki.hu/chemonet/ http://www.ch.bme.hu/chemonet/ |