Jedlovszkyné Fuxreiter Mónika
Xilóz izomeráz vizsgálata röntgen-krisztallográfiával és molekulamodellezéssel
Eötvös Loránd Tudományegyetem, Budapest
1996
Eredmények összefoglalása
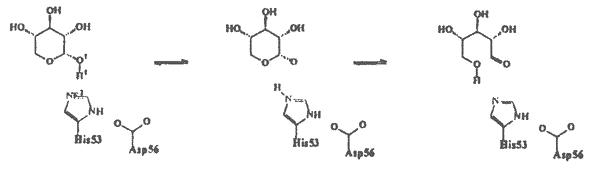
Munkám során a xilóz izomeráz enzim mûködésének részleteit vizsgáltam kvantumkémiai és molekulamechanikai számítások segítségével. Ennek alapján a xilóz– xilulóz átalakulás mechanizmusára az 1. sémán közölt javaslatot tettem.

Gyûrûfelnyílás
Protonátadás
Hidrid-transzfer
1. séma
Kiszámítottam a gyûrûfelnyílási és a hidrid-transzfer lépés energiagátját 10 Å sugarú enzimkörnyezetet figyelembe véve és ennek alapján megállapítottam, hogy a xilóz-xilulóz reakció sebességmeghatározó lépése az izomerizációs, azaz a hidridion vándorlási lépés. A szemiempirikus PM3 módszerrel végzett számítások a reakció néhány eddig nem bizonyított részletére is fényt derítettek (pl. proton-átadási lépés mechanizmusa). Tanulmányoztam különbözõ fémionok hatását a reakcióra, és az enzim különbözõ fémionokat tartalmazó aktív centrumának töltéseloszlását összehasonlítva kiderült, hogy az egyes fémionok aktiváló illetve gátló hatását elsõsorban nem geometriai, hanem elektrosztatikus tényezõk befolyásolják. Minél nagyobb a töltésátmenet a szubsztrátról egy adott fémionra, annál kevésbé aktív az adott fémion-enzim komplex.
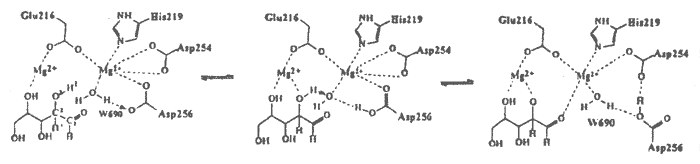
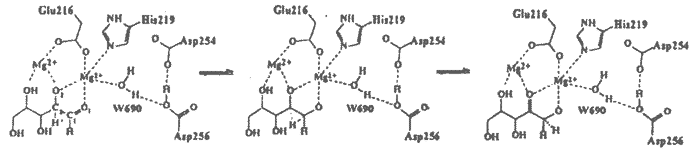
Annak érdekében, hogy D254E/D256E xilóz izomeráz mutáns kinetikus adatait molekuláris szinten értelmezzem, elõször a mutáció okozta szerkezeti változásokat vizsgáltam röntgendiffrakciós módszerrel. Meghatároztam a D254E/D256E xilóz izomeráz mutáns Mg2+-ot tartalmazó biner komplexének, valamint három xilitol inhibitort és kétvegyértékú fémionokat (Mg2+, Mn2+, Ca2+) tartalmazó terner komplexének szerkezetét molekuláris helyettesítés módszerével. A Glu-Asp helyettesítés sem az enzim fõláncának, sem az aktív centrum más oldalláncainak szerkezetét lényegesen nem érintette (RMS = 0.15 illetve 0.32Å), hatására azonban a katalitikus fém kötõhelyének mérete csökkent a beépített glutaminsavak hosszabb oldalláncai miatt. A mutáns terner komplexeiben a katalitikus fémionok egyetlen helyen kötõdtek, mely megfeleltethetõ a natív enzimben leírt 22 pozíciónak, bár a koordinációban eltérések mutatkoznak. Ezen a helyen a mutánsban a fémion az inhibitor O1 és O2 atomjához, valamint a Glu-216 és His-219 aminosavakhoz kapcsolódik, a natív enzimhez hasonlóan. A hosszabb glutaminsav oldalláncok (254 és 256) azonban a natív enzim megfelelõ aszparaginsavjaitól eltérõen ezen a helyen is koordinálódnak a fémionhoz. Lényeges különbség továbbá, hogy a mutáns enzimbõl hiányzik az a W690 vízmolekula, mely a natív enzimben a katalitikus helyen lévõ fémionhoz koordinálódott.

2. séma
A D254E/D256E mutáns az elsõ olyan xilóz izomeráz, melynek terner komplexeiben mind az aktiváló, mind a gátló ionok kötõdését sikerült megfigyelni, mindkét fémkötõ helyen. A xilitolt és Mg2+, Mn2+, illetve Ca2+ ionokat tartalmazó komplexek szerkezetei nagy hasonlóságot mutattak mind a strukturális, mind a katalitikus helyen lévõ fémionok koordinációjában. A Ca2+ ionnak az ún. katalitikus helyen történõ kötõdése ellentmond az eddigi feltételezéseknek, miszerint a Ca2+ -gátló hatásának oka, hogy nagyobb ionmérete miatt nem képes a szubsztrát O1 és O2 atomjához is kapcsolódni, és ezen sztérikus kényszer miatt nem kötõdik a katalízis szempontjából fontos 22 helyen. A röntgendiffrakciós adatok szerint az inhibitor hatású Ca2+ és a katalitikus hatású Mg2+ és Mn2+ ionok is oktaéderes koordinációval kötõdnek a 22 helyen, tehát a fémionoknak az enzimmûködésre gyakorolt eltérõ hatása nem sztérikus tényezõk következménye. A mutáns Mg2+, Ca2+ és Be2+ komplexeire végzett töltéseloszlás számítások alátámasztották az eddigi eredményeket, azaz a fémre történõ töltésátmenet összefúggésbe hozható az enzim katalitikus aktivitásával (vagy inaktivitásával). A natív és a mutáns enzim sebességmeghatározó lépésére végzett aktiválási energia számítások kvalitatíven visszaadták azt a kísérleti tényt, hogy a mutáns enzim aktivitása csökkent a natív enzimhez képest. Ez a töltéseloszlás vizsgálata alapján azzal magyarázható, hogy a mutáns enzim kevésbé képes stabilizálni a hidrid-transzfer reakció poláros átmeneti állapotát, mint a vad típusú enzim. A katalitikus vízmolekulának a mutáns enzim röntgenszerkezetében észlelt hiánya pedig felhívja a figyelmet arra, hogy új mutánsok tervezésénél a protonátadási folyamat lehetséges útjait is figyelembe kell venni.
Crystallographic and molecular modelling studies on xylose isomerase
Ph.D. thesis, Eötvös Loránd University, Budapest
1996
Mechanism of xylose-xylulose conversion
I investigated the catalytic mechanism of xylose isomerase action by quantum chemical and molecular mechanical calculations and proposed a scheme (see scheme 1 in the Hungarian text) for the mechanism. I calculated the energy barriers of the ring opening and the hydride transfer steps including the enzyme environment within 10 Å radius. Comparing the activation energies of these reactions it turned out that the hydride transfer is the rate determining step of the xylose-xylulose conversion. Several details of the isomerisation were revealed by the simulations carried out by the semiempirical PM3 method, eg. the mechanism of the proton shuttle step.
Structure determination of xylose isomerase double mutant complexes
In order to interpret the kinetic data of D254E/D256E double xylose isomerase mutant in molecular terms I studied the structural changes caused by the Asp-Glu replacement by X-ray crystallography. I determined the crystal structure of four complexes of D254E/D256E xylose isomerase double mutant, a binary complex with Mg2+ ions, and three ternary complexes containing xilitol inhibitor and bivalent metal cations (Mg2+, Mn2+, Ca2+) by molecular replacement method. The intrusion of the longer side-chains with the Glu-Asp replacement remarkably reduced the space available for binding at the catalytic metal site, however, it did not effect the global structure of the enzyme, the structure of the backbone and other side chains of the active site are only slightly effected by the mutation (the RMS deviation is 0.15 and 0.32 Å, respectively). The catalytic metal ions were observed to bind at a single site in the ternary complexes of the double mutant, which corresponds to the 22 position in the wild type enzyme, although some differences in coordination were also found. The catalytic metal ion at this site is ligated to the Ol and O2 atoms of the inhibitor, and also binds to the Glu-216 and His-219, similarly to the native enzyme. The longer side chains of the glutamates (254 and 256), however, are also coordinated to the catalytic metal ion. The W690 water molecule, which bound to the catalytic metal ion in the native enzyme and played important role in the proton shuttle step, could not be observed in the crystal structures of the ternary complexes ofthe double mutant.
Role of metal ions in xylose isomerase catalysis
I studied the effect of different metal ions on the xylose-xylulose conversion catalysed by xylose isomerase by quantum chemical calculations. The analysis of the charge distribution of the enzyme active site containing different metal ions showed that the activating or inhibiting properties of metal ions depend on electrostatic factors rather than geometric ones. The larger is the charge transfer from the substrate to the metal ion the less is the catalysis.
The crystal structure of the D254E/D256E xylose isomerase double mutant is the first case, where the binding of activating as well as inhibiting metal ions could be observed at both binding sites. The ternary complexes containing xilitol inhibitor and Mg2+, Mn2+, and Ca2+ ions showed high degree of similarity at both structural and catalytic metal site. The binding of Ca2+ ions at the catalytic metal site disproves the previous assumptions, that the larger Ca2+ ions are sterically not capable to bind at the catalytically important 22 site, therefore they inhibit the catalysis. In the crystal structures of the ternary complexes of the xylose isomerase double mutant the inhibitory Ca2+ ions similarly to the activating Mg2+ and Mn2+ ions were observed to bind at 22 site with the same octahedral coordination, therefore the different effect of these metal ions on the enzymatic activity of the double mutant can not be the consequence of geometric differences. Instead, the charge distribution calculations showed correlation between the charge transfer towards the metal ions and the catalytic efficiency of the complex, which confirms the hypothesis established for the native enzyme.
Interpretation of the reduced activity of the double mutant
The activation energy calculations carried out on the double mutant as well as on the native enzyme showed that the double mutant is less active than the wild type enzyme in agreement with the experimental data. On the basis of the inspection of the charge distributions of the active sites of these enzyme it can be concluded that the double mutant is less capable to stabilise the highly polar transition state of the hydride transfer reaction then the wild-type enzyme. The absence of the catalytic water molecule in the crystal structures of the double mutant remarkably effects the choreography of the proton shuttle step, therefore This effect must be taken into consideration when new, Ca2+ resistent xylose isomerase mutants is designed.
Publications
1. Monika Fuxreiter, Ödön Farkas, Gábor Náray-Szabó: Molecular modelling of xylose isomerase catalysis: the role of electrostatics and charge transfer to metals. Protein Engineering, 8 (1995) 925.
2. Monika Fuxreiter, Zsolt Böcskei, Anikó Szeibert, Erika Szabó, Géza Dallman, Gábor Náray-Szabó, Bence Asbóth: The role of electrostatics at the catalytic metal binding site in xylose isomerase action. Ca2+ inhibition and metal competence in double mutant D254E/D256E. Proteins: Struct. Funct. Genet., közlésre elfogadva
3. M. Fuxreiter, A. Csámpai, J. Császár: Formation of a strained triazapentalenoindene skeleton via the rearrangement of 2,3- dihydro-7-nitro-1 H-imid-azo[2,1-a]phtalazin-4-ium-6-olate effected by dichloro-actetic anhydride. Heterocycles, 38 (1994),1453.
4. I. Fernandez, J. Ubach, M. Fuxreiter, J.M. Andreu, D. Andreu, M. Pons: Conformation and self association of a hybride peptide of cecropin-A and melittin with improved antibiotic activity. Chemistry A European Journal 2 ( 1996) 180.
5. G. Náray-Szabó, M. Fuxreiter, A. Warshel: Electrostatic basis of enzyme catalysis. in Computational Approaches to Enzymatic Reactivity (ed. G. Náray-Szabó & A. Warshel) Kluwer, Dordrecht, nyomtatásban
| Vissza a tartalomjegyzékhez Back to Contents |
http://www.kfki.hu/chemonet/ http://www.ch.bme.hu/chemonet/ |