az MTA külső tagja
MINIATÜRIZÁLÁS AZ ELVÁLASZTÁSTECHNIKÁBAN:
Elektroforézis mikrochipek alkalmazása a modern bioanalitikában
In Memoriam Professzor Horváth Csaba
Elhangzott 2004. október 12-én (részletek)
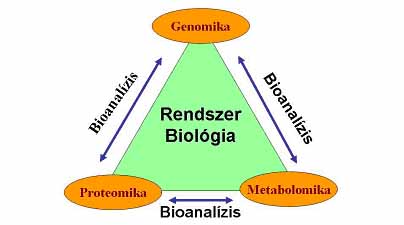
Napjainkban az újabb és újabb molekuláris biológiai módszerek kidolgozása egyre szorosabb kapcsolatba kerül a műszaki tudományokkal, és az egyre hatékonyabb, egyre jobban automatizált technikák megvalósítása ezen szakterületek közös feladata. A természet-tudományokban az utóbbi évtizedben bekövetkezett paradigmaváltás következtében a kémiai, biokémiai és molekuláris biológiai módszerek mindinkább a rendszer biológia (1. ábra); az organizmus egy kisérletben történő, globális, átfogó vizsgálata felé tolódnak. A genomika, proteomika és metabolomika rohamosan növekvő igényeinek és a technikában megfigyelhető általános fejlődési tendenciáknak megfelelően a miniatürizálás az elválasztástechnikák körében is egyre inkább tért hódít, mivel egyre kisebb térfogatú, ugyanakkor nagyszámú minta kis helyen történő, gyors analízisét teszi lehetővé (Heller és Guttman 2002).
Korunkban a komplex biológiai minták vizsgálatánál elengedhetetlen az olyan modern bioanalitikai módszerek alkalmazása, mint a genom térképezés és szekvenálás, proteom analízis és szekvenálás, valamint metabolom analízis és azonosítás. Az kapott adatokat bioinformatikai módszerek segítségével hasonlítjuk össze a már meglévő adatbázisokkal, ami nagymértékben megkönnyíti a differenciáltan kifejezett gének illetve géntermékek azonosítását és hasznosítását napjaink orvostudományában és a modern gyógyszerkutatás/ fejlesztés során (Darvas, Guttman és Dorman 2004). A múltban a kémiai szintézissel előállított molekulákat egyszerűen próba – szerencse alapon vizsgálták. Ma a nagy mennyiségben rendelkezésre álló kombinatorikus kémiai könyvtárak lehetővé teszik, hogy milliószámra vizsgáljunk újabb és újabb vegyületeket. Így a gén szekvenciák és gén termékek ismeretében egyre inkább áttérünk a biológiai fekete doboz vizsgálatáról a rendszer biológiai megközelítésre. A modern orvostudományi kutatások ennek kapcsán genomikai adatbázisokból kiindulva a transzkriptom, proteom és metabolom feltérképezésén keresztül érnek el újabb és újabb eredményeket. E célok eléréséhez azonban feltétlenül szükség van modern és nagyhatékonyságú elválasztási technikák kifejlesztésére. Ezen módszereknek meg kell felelniük korunk és természetesen a vizsgált biológiai rendszer kívánalmainak, úgymint kismennyiségű minták (mikro- és nanoliter térfogatok) gyors analízise (másodperces elválasztási idők), nagy felbontóképesség és olyan enyhe elválasztási körülmények, amelyek lehetővé teszik a szeparált komponensek további azonosítását, többnyire tömegspektrometriával vagy mikroszekvenálással (Rathore és Guttman 2003). A detektálási érzékenységnek bizonyos esetekben el kell érnie az egy molekula kimutathatósági határt. Ezen modern elválasztási módszereket főleg a rendszer biológia részterületein használjuk, de ezen túl természetesen alkalmazást találnak biomarkerek felfedezésénél, metabolizmus utak analízisében és gyógyszer céltermékek validálási eljárása során.
A korszerű műszeres bioanalitika egyik alapmódszere a nagynyomású folyadékkromatográfia
(HPLC), melyet Horváth Csaba professzor fejlesztett ki csaknem négy évtizeddel
ezelőtt (Karger, Snyder és Horváth 1973). A technika azóta igen komoly
fejlődésen ment keresztül és napjainkban a nagy hatékonyságú folyadékkromatográfiás
készülékek világszerte az élettudományokkal és gyógyszerfejlesztéssel foglalkozó
laboratóriumok mindegyikében megtalálhatók. Az utóbbi évtizedben a nagy
hatékonyságú folyadék-kromatográfiás módszerek továbbfejlesztése két- sőt
több-dimenziós rendszerekké komoly előrelépést jelentett a proteomikai
és matabolomikai kutatásokban szükséges nagy felbontóképesség eléréséhez.
A modern bioanalitika és molekuláris biológia másik leggyakrabban használt
elválasztástechnikai módszere az elektroforézis. A poliakrilamid és agaróz
gélt alkalmazó elektroforézis technikák alapvető fontosságúak a genomikában
és proteomikában. A konvencionális (lap) gél elektroforézis lehetővé teszi
mind egy-, mind két-dimenziós elválasztási rendszerek alkalmazását. A tömegspektrometria
és mágneses magrezonancia spektroszkópia szintén fontos szerepet játszik
a modern bioanalitikában, különösen csatolt módszerek alkalmazásánál, azaz
valamilyen elválasztástechnikai módszerrel összekötve. Ezek a modern kapcsolt
rendszerek tették lehetővé az olyan nagyhatékonyságú elválasztási és azonosítási
módszerek bevezetését, mint például a nanoLC-nanoLC/MS2-en alapuló multidimenzionális
fehérje azonosítási technika (MUDPIT), amely napjaink proteomika kutatásának
egyik leggyakrabban alkalmazott módszere. A kapilláris elektroforézist,
mint elválasztási technikát csaknem két évtizede használjuk főképpen biomolekulák
gyors analízisére (Karger, Cohen és Guttman 1989). A Guttman és munkatársai
által a 90-es évek elején kifejlesztett, géllel töltött kapillárisok olyan
nagyfelbontású DNS elválasztásokat eredményeztek, ami a későbbiekben lehetővé
tette a humán genom évekkel a tervezett időpont előtti teljes szekvenálását
(Cohen, Najarian, Paulus, Guttman és mtsi 1988; Guttman 2003). A kapilláris
elektroforézissel nem csak DNS molekulákat, hanem fehérjéket (Ganzler,
Greve, Cohen, Karger, Guttman és mtsi 1992; Guttman, Horváth és Cooke 1993)
és komplex szénhidrátokat (Guttman 1996) is nagy sikerrel választhatunk
el.

2. ábra Elektroforetikus mikrochip mérete az egyforintos érmével összehasonlítva
A mikrochip elektroforézis (Khandurina és Guttman 2003) a kapilláris elektroforézisből fejlődött ki és napjaink legmodernebb elválasztástechnikai eszközei közé tartozik, mely biológiailag fontos molekulák – ugymint a DNS, fehérjék és komplex cukrok – gyors és hatékony elválasztására alkalmas. A módszer azért kapta ezt a nevet, mert a kémiai chipek előállítása a számítógépchipek gyártása során alkalmazott technikákat (fotolitográfia, kémiai maratás, stb.) hasznosítja (Heller és Guttman 2002). A miniatürizálás számos előnnyel jár különösen azon alkalmazások esetében, ahol nagy számú minta gyors elemzése szükséges, ami a rendszer biológia korszakában alapvető fontosságú. Az analízis kis méretű üveg vagy műanyag lapba maratott csatornákban történik (2. ábra), és a néhány cm hosszúságú kapillárisokban a nanoliternyi mennyiségű minták elemzése csupán másodperceket, esetleg perceket vesz igénybe (Ronai, Barta, Sasvari-Szekely és Guttman 2001).
A miniatürizálás több nagyságrend előrelépést jelent, nemcsak az elválasztás gyorsasága, hanem annak felbontóképessége szempontjából is. Emellett hagyományosan egymást követő kémiai és biokémiai reakciók valamint elválasztási lépések – úgymint polimeráz láncreakció (PCR), restrikciós enzimes emésztés (RFLP), DNS-fragmentum analízis – akár egyetlen monolitikus mikrochipben is elvégezhetők (Chovan és Guttman 2002). A miniatürizálás előnyei közé tartozik a kis reagens igény, csökkentett oldószer felhasználás és gyors analízisidő. Ugyanakkor ezen módszer magában hordozza a multiplex, integrált rendszerek kialakításának lehetőségét is. Sokcsatornás chipek alkalmazásával akár több száz minta párhuzamos vizsgálata válik lehetővé (96, 384, stb.), s mivel ezen új módszer könnyen automatizálható, mindez jelentős munka-, idő-, anyag- és költség-megtakarítást jelent. A kémiai mikrochipek bevezetésével a közeljövőben az analitikai kémiai laboratóriumok gyökeres változásának nézünk elébe (Khandurina, Zhu és Guttman 2003). Hasonlóan a számítástechnika robbanásszerű fejlődéséhez, mely lehetővé tette, hogy Neumann János egykori többszobát elfoglaló számítógépét ma már egy kis laptop számítógéppel helyettesítsük, az általunk manapság elfogadott analitikai kémiai laboratórium akár hitelkártya méretűre is lekicsinyíthető (Guttman 2000). Abból kiindulva, hogy a számítógépek központi processzorainak sebessége nagyjából 18 havonta megduplázódik, felmerül a kérdés, hogy vajon a kémiai chip technológia képes lesz-e felvenni ezt az iramot?
Mielőtt azonban jobban belemerülnék a kémiai chipek részletes leírásába, szeretném megragadni az alkalmat, hogy felhívjam a figyelmet a DNS/fehérje chipek és az elválasztástechnikai kémiai chipek közötti alapvető különbségre. Maga a kémiai chip mindkét esetben speciális mikromegmunkálási eljárással készül, de míg a DNS/fehérje chiphez akár több százezer DNS vagy fehérjemolekula köthető, lehetővé téve annak tömeges diagnosztikai alkalmazását, addig az elválasztástechnikai mikrochipek magas szelektivitásukkal tűnnek ki (Khandurina és Guttman 2002). A DNS chipek működésének alapelve azonos a Southern-blot ill. a reverse dot blot hibridizációs módszerekével, a legfőbb különbség a méretdimenziókban, és ebből következőleg a hatékonyságban van. A módszer lényege ebben az esetben kvázi szekvencia-analízis: a vizsgált DNS a chip felszínén rögzített – ismert bázissorrendű – próbákhoz kötődik, aminek alapján a minta szekvenciájára következtetünk. A technika minőségi és mennyiségi analízisre egyaránt alkalmas. Fő felhasználási területe a génexpresszió elemzése és mutációk illetve egypontos nukleotid polimorfizmusok (pont polimorfizmus: SNP) valamint rövid, 1–5 bázispárt érintő inzerciók, mikroszatellita polimorfizmusok és deléciók ezreinek, tízezreinek párhuzamos vizsgálata. Hasonlóképpen a DNS chipekhez, a fehérjechipekre nagyszámú fehérjét (pl., antitestet) kötnek, és ezek segítségével vizsgálnak egész sejtkivonatokat, illetve különböző testfolyadékokat (Khandurina, Zhu és Guttman 2003).
Lényegesnek tartom itt megjegyezni, hogy az úgynevezett „Lab-on-a-chip” megközelítés napjainkban már a realitás szintjén áll, lehetővé téve számos egymást követő műveleti lépés pl, kémiai reakciók, mintaelőkészítés, elválasztás és frakcionálás gyakorlatilag egyetlen mikrochipen történő megvalósítását egy megfelelően kialakított monolitikus rendszerben (Chovan és Guttman 2001). Az elektroforézis mikrochip elkészítésének első lépése a csatornahálózat és reagenstartó edények elrendezésének megtervezése annak tudatában, hogy mit várunk el a kémiai chiptől. A következő lépés a terv megfelelő chip-alapanyagra való átvitele felhasználva a számítógépes mikrochipek gyártásánál bevezetett és ma már nagyiparilag is alkalmazott módszereket. Ezzel a technikával akár több ezres nagyságrendben is előállíthatók elektroforézis chipek. Megfelelő detektorok alkalmazásával femto- és attomol mennyiségű minta detektálása lehetséges, és az így kialakított mikrochipek 10, sőt 100-szoros analízis sebességet biztosítanak a konvencionális elválasztási módszerekhez képest. Különösen előnyös, hogy már meglévő és beállított folyadékkromatográfiás vagy kapilláris elektroforézis módszerek egyszerűen átültethetők mikrochip formátumra. Többcsatornás chipek alkalmazásával (96, 384, vagy több csatorna) akár nagyságrendekkel is megnövelhető a rendszer kapacitása, és az így nyert hatalmas adathalmaz megfelelően gyors számítógépekkel rövid idő alatt kiértékelhető (Darvas, Guttman és mtsi 2004).
Elektroforézis mikrochipeket mikromegmunkálással készíthetünk üvegből, kvarcból és különböző műanyagokból, úgymint polimetil-metakrilát, teflon, polikarbonát, stb. A mikrochipekre jellemző rendkívül magas felület–térfogat arány előnyös az elektroforetikus folyamatban felszabaduló hő gyors elvezetése szempontjából. Ugyanakkor a kémiai chip alapanyag kiválasztásánál megfontolandó, hogy miniatürizált körülmények között ezen nagy felület anyagi minősége is fontos szerepet játszhat. Ez különösen lényeges lehet fehérjék elektroforézise ill. kémiai reakciók (polimeráz láncreakció, restrikciós emésztés) során, amikor a negatív töltésű üvegfelszín esetleg gátló tényezőként szerepelhet (például nem-specifikus kötődés). Műanyagok alkalmazása esetén ezzel a kedvezőtlen hatással kevésbé kell számolnunk, emellett a műanyagból készült kémiai chipek olcsók, nem törékenyek és könnyen megmunkálhatók (Berdichevsky, Khandurina, Guttman és mtsi 2004).
Üvegből készült elektroforézis mikrochipek esetén a mintakomponensek
elválasztása kisméretű üveglapba maratott csatornákban történik, melyek
általában 10–40 µm mélyek és 60–200 µm szélesek (2. ábra). A kialakított
munkacsatornákban egyszerű pufferoldatoktól a bonyolult géleken keresztül
a monolitikus elektrokromatográfiás állófázisokig bármilyen elválasztó-rendszert
alkalmazhatunk. Az elektroforézis mikrochipek tipikus mérete néhány centiméter,
ámbár 96 és 384 csatornás chipek esetén elérheti a 20-30 cm-t is. A csatornák
a mikrochip felszínén lévő nyílásokban végződnek, amik az oldatok (minta,
puffer, szeparáló mátrix) betöltésére szolgálnak (3. ábra). Az ide
csatlakozó elektródok segítségével az egyes csatornákban különböző nagyságú
és polaritású elektromos mezők alakíthatók ki, amelyek alkalmasak a mikrochipben
lévő anyagok mozgatására és a mintakomponensek elektroforetikus elválasztására.
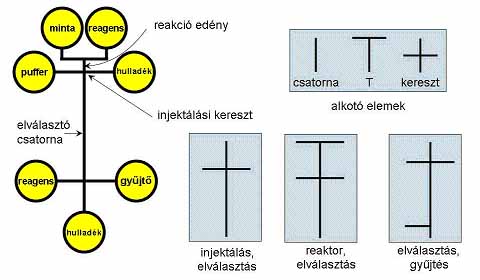
3. ábra Integrált elektroforézis mikrochip főbb csatornahálózati alkotóelemei (Guttman 2001)
A pufferoldatok és a minta mozgatása az általában alkalmazott elektrokinetikus
módon kívül még nyomással/vákuummal is elérhető. A legegyszerűbb mikrochipek
két, egymást keresztező csatornát tartalmaznak. A rövidebb csatorna a minta
injektálására, a hosszabb az elektroforetikus elválasztásra szolgál. Két
mintatartály alkalmazásával egyetlen csatornában is igen pontos molekula
méretmeghatározás válik lehetővé, a minta és megfelelő molekulatömegű marker
egyidejű injektálásával és elválasztásával. A 3. ábrán bemutatott egyszerű
alkotóelemek, úgymint egyenes csatorna, T elágazás vagy kereszt alakú csatlakozás
felhasználásával, igen komplikált integrált rendszereket alakíthatunk ki
(Guttman 2001). Így egyszerűen összekapcsolható egy kémiai/biokémiai reaktor
egység az injektáló rendszerrel, az elválasztócsatornával és egy esetleges
frakciószedővel az elválasztó csatorna megfelelő részén. Ugyanakkor ma
már lényegesen összetettebb elrendezésű elektroforetikus mikrochipek is
léteznek: 10 cm átmérőjű mikrochip sugár irányú csatornáiban 96 minta egyszerre
vizsgálható (Khandurina és Guttman 2002). Az ilyen sokcsatornás mikrochipre
a minták felvitele általában folyadék kezelő automatákkal történik, és
egy minta analízisének ideje átlagosan 5 másodperc.
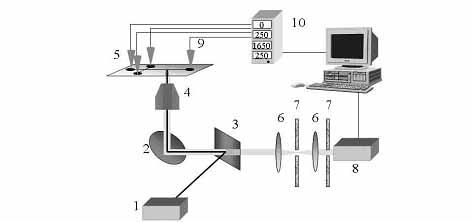
4. ábra. Az elektroforetikus mikrochip berendezés felépítésének
vázlata. 1: lézer, 2: tükör, 3: kettőstörő tükör, 4: mikroszkóp objektív,
5: elektroforetikus mikrochip, 6: lencsék, 7: optikai szűrők, 8: detektor,
9: puffer tartályok, 10: nagyfeszültségű tápegység (Ronai, Sasvari-Szekely,
Chovan és Guttman 2002)
Az elektroforetikus mikrochip tervezése során megfelelő számítógép programokat is alkalmazhatunk, melyek segítségével jól szimulálhatjuk a mikrochipen lejátszódó reakciós és elválasztási lépéseket (Chovan és Guttman 2002). A megfelelő tervrajz birtokában első lépésként fotolitográfiás módszerekkel elkészítjük a chipen a kialakítandó csatornahálózatot. Ez üveg alapanyag esetén ammónium-fluorid és hidrogén-fluorid keverékkel történő maratással végezhető el. A kívánt csatornamélység elérése után (általában 20–50 µm), a kialakított csatornahálózatot megfelelően előkészített üveg, vagy műanyaglappal lefedjük, és hőkezeléssel (~600 °C) vagy ragasztással (Na2SiO3) rögzítjük. Az így kapott zárt csatornarendszer végein megfelelő átmérőjű (~1–2 mm) lyukakat fúrva oldhatjuk meg a ”makro” - világgal való kommunikációt, elektródok, oldatok bevezetését, mintainjektálást, stb. (Khandurina és Guttman 2002). Mint korábban már említettem, az elektroforetikus mikrochip előállítására szolgáló két fő alapanyag típus az üveg és a megfelelő műanyagok. Az üveg előnye jó optikai és hővezető tulajdonságai, és a már nagyszámban rendelkezésre álló felületkezelési illetve derivatizálási módszerek. Hátránya azonban az üvegből készült chipeknek, hogy még tömeges gyártás esetén is igen drágák. Ugyanakkor a műanyagból készült chipek optikai és hővezető tulajdonságai változóak, és bizonyos esetekben még autofluoreszcenciával is számolnunk kell. További hátránya a műanyag chipeknek, hogy a rendelkezésre álló kémiai felületkezelési és derivatizációs módszerek száma korlátozott. Kihangsúlyozom viszont, hogy a műanyag chipek előállítása kifejezetten olcsó, ami lehetővé teszi az egyszer használatos, eldobható chipek alkalmazását (Darvas, Guttman és Dorman 2004). A detektálás a mikrochipen főképpen lézer indukált fluoreszcencia (LIF) segítségével történik, de emellett más módszerek, mint ultraibolya fényelnyelés, elektrokémiai és tömeg-spektrometriai technikák is alkalmazhatók (Guttman és Khandurina 2003). A detektálás a HPLC-hez hasonlóan csaknem minden esetben „on-line” módon történik. Kutatólaboratóriumomban felépített és alkalmazott elektroforézis mikrochip detektor-rendszer felépítésének sémáját a 4. ábra mutatja (Ronai, Sasvari-Szekely, Chovan és Guttman 2002). Lézer indukált fluoreszcens detektálás esetén a mikrochipet egy fordított konfokális mikroszkóp tárgyasztalán helyezzük, és a megfelelő hullámhosszúságú lézer sugarat az objektív segítségével a mikrochip elválasztó-csatornájának egy adott pontjára fókuszáljuk.
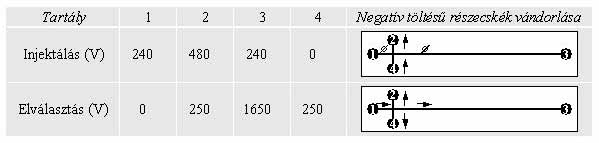
1. táblázat Elektrokinetikai injektálás és elválasztás során alkalmazott feszültségértékek egyszerű keresztelrendezésű mikrochip esetén (Ronai, Sasvari-Szekely, Chovan és Guttman 2002)
A mintaadagolás két fő módja az úgynevezett elektrokinetikus és zárt kapus injektálás. Az 1. táblázatban bemutatott konfiguráció esetén a 4. mélyedés a mintát, az 1., 2. és 3. mélyedések pedig a futtató puffert tartalmazzák. Elektrokinetikus injektálás során a minta a mintatartó tartályból áramolva (1. táblázat, 4-es pozíció) megtölti a rövid mintatartó csatornát (4 => 2) és ennek megfelelően a rövid (mintatartó) és a hosszú (elválasztó) csatornák kereszteződését. Az ezt követő elektroforézis analízis során ténylegesen a mintának csak azt a kis részét injektáltuk, ami a mintatartó csatorna feltöltése után éppen a kereszteződésben van. Zárt kapus injektálás esetén ezzel szemben a kapocsfeszültségek változtatásával tetszés szerint állíthatjuk be az injektált minta térfogatát (Khandurina és Guttman 2002). Mindkét injektálási módot követően az elválasztás során a kapocsfeszültségeket úgy választjuk meg, hogy a kapillárisok kereszteződésében lévő molekulák az elválasztó csatornában az injektálási pont irányából mozogjanak a detektálási pont felé, ugyanakkor a futtató puffer egy része lassan visszaáramoljon az elválasztó csatornából a minta, illetve a gyűjtő tartályok felé. Ez a beállítási mód a jó felbontású mikrochip elektroforézis alapfeltétele, mivel ha a minta az elválasztási lépés során folyamatosan „beszivárog” az elválasztó csatornába, akkor éles csúcsok helyett elmosódott, emelkedő alapvonalú elektroferogramot kapunk. Az injektálás és az elválasztás során alkalmazott feszültségértékeket ennek megfelelően kell beállítani, amint azt az 1. táblázat mutatja (Ronai, Sasvari-Szekely Chovan és Guttman 2002).
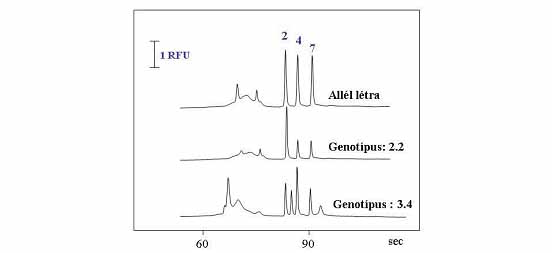
5. ábra. A D4-es dopamin receptor DRD4 gén III. exon 48 bp VNTR
gyors genotipizálása mikrochip elektroforézissel (Barta, Ronai, Nemoda,
Szekely, Kovacs, Sasvari-Szekely és Guttman 2001)
A leggyakrabban használt egyszerű mikrochip alkalmazások mellett (DNS-fragmentum
analízis, fehérjék SDS gél elektroforézise, komplex szénhidrátok elválasztása,
stb.) olyan integrált rendszereket is kidolgozhatunk, melyek korábban a
konvencionális módszerek alkalmazásával elképzelhetetlenek voltak. Egyetlen
folyamat részeként a mikrochip csatornáiban polimeráz láncreakció (PCR),
mintakoncentrálás valamint restrikciós emésztés (RFLP) is elvégezhető (Rathore
és Guttman 2003), így a módszer igen hatékonyan használható gyors DNS analízisre,
és egyszerűen alkalmazható mind egypontos nukleotid polimorfizmusok (SNP),
mind pedig hosszúság-polimorfizmusok (VNTR) vizsgálatára és genotipizálásra
(5. ábra) ahogy azt munkacsoportommal bemutattuk (Barta, Ronai és
mtsi 2001; Guttman, Khandurina és mtsi 2003). Megfelelő körülmények között
olyan nagy felbontóképességet érhetünk el, hogy bizonyos mikrochip konfigurációkat
DNS-szekvenálásra is alkalmazhatunk (Karger és Guttman 2003). Az elektroforetikus
mikrochipek ezen felül nagyszerűen alkalmazhatók a modern gyógyszer kutatás-fejlesztésben
nagy-kapacitású biológiai szűrésre, dózis-hatás elemzésre és tömeges minta
analízis esetén (Darvas, Guttman és Dorman 2004).
Az elektroforézis mikrochipek amellett, hogy kiválóan használhatók
kis mennyiségű biológiai minták analízisére, mikropreparatív célokra is
alkalmazhatók. Különösen komplex DNS minták esetén érdekes ez az elválasztási
forma, mivel a polimeráz láncreakció elterjedése óta gyakorlatilag néhány
DNS molekula is elegendő ahhoz, hogy további szekvenálási vagy klónozási
kísérletekhez megfelelő mennyiségű anyagot nyerjünk (Guttman, Fules és
mtsi 2003; Liu és Guttman 2004). Legegyszerűbben a már korábban említett
és a 6. ábrán is bemutatott kereszt elrendezés használható frakciószedésre
(Khandurina, Chovan és Guttman 2002). Ebben az esetben a detektálási lézersugarat
pontosan a kereszteződésre irányítjuk miközben az elválasztási csatornában
szétválasztott komponensek egyenként haladnak az elektromos erőtér hatására
a csatorna-kereszteződés és ennek megfelelően a detektálási pont felé.
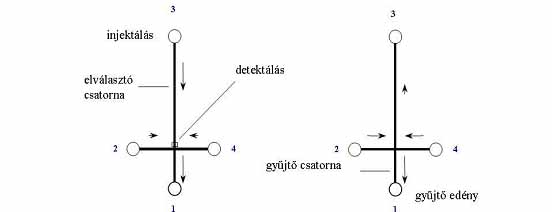
Az első gyűjteni kívánt komponens detektálásakor a kereszteződés egyes végeire adott feszültségeket úgy állítjuk át, hogy az elválasztó csatornában a komponensek lehetőleg ne mozogjanak, ugyanakkor a frakciógyűjtő csatornában a kiválasztott komponens mielőbb elérje a gyűjtő edényt. Ezt a műveletet annyiszor ismételjük, ahány frakcióra van szükségünk. Külön kihangsúlyozandó, hogy ezzel a módszerrel nemcsak időben, hanem térben is jól elválaszthatók az egymáshoz egyébként közel vándorló mintakomponensek (Khandurina és Guttman 2002). A vázolt módszer remekül alkalmazható nagyszámú minta klónozása esetén (7. ábra), amikor különösen lényeges az egyes DNS fragmentumok tisztasága a szintetizálandó fehérje minősége szempontjából (Ronai és Guttman 2000).
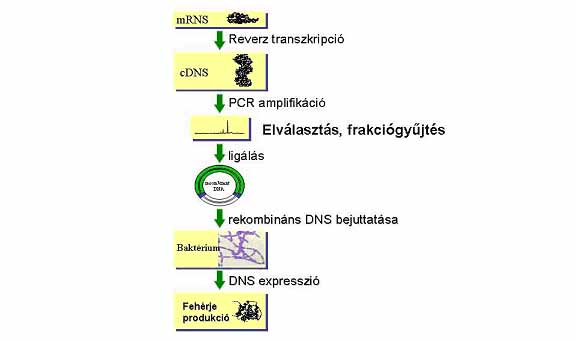
Előadásomat összefoglalva szeretném kihangsúlyozni, hogy a kémiai és biológiai tudományok rohamos fejlődése új igényeket és ezeknek megfelelő új megoldásokat eredményezett az elektroforetikus elválasztási technikák területén is. Az egyik legújabb módszer gyors analízisek elvégzésére a mikroelektroforézis, az ún. elektroforézis mikrochip technika (Heller és Guttman 2002). Az elektroforézis mikrochip lényegében miniatürizált kapilláris elektroforézis berendezésnek tekinthető, így a már kidolgozott valamint már részben beállítás alatt álló alkalmazások kiemelkedően széles körűek. A miniatürizálás komoly előrelépést jelent, mivel nemcsak az elválasztás sebessége, hanem annak felbontóképessége is nagyságrendekkel emelkedik. Amennyiben szükséges kémiai és biokémiai reakció egységek és elválasztási csatornák integrálhatók egy monolitikus mikrochipre, akár oly módon is, hogy 96 egymástól független rendszer, illetve akár ennek többszöröse (384, 1536, stb.) ráférjen. Ez utóbbi esetben megfelelő folyadékadagoló automata segítségével az összes minta (96, 384, 1536, stb) egyszerre injektálható. Az eredmények kiértékelése megfelelően gyors és nagy kapacitású számítógép segítségével csupán másodperceket vesz igénybe. Ez a kémiai mikrochipekkel egyszerűen megoldható integráció jelentős idő-, költség- és munkamegtakarítást jelent különösen a rendszer biológia területén ideértve a genom, proteom és metabolomkutatási alkalmazásokat.
Köszönetnyilvánítás
Előadásom végén szeretnék köszönetet mondani mindazoknak, akik közvetlenül
vagy közvetve hozzájárultak ahhoz, hogy ezt a székfoglalót ma megtarthattam.
Elsősorban azoknak a hazai szakembereknek mondanék köszönetet, akik szakmai
pályám fejlődésének elősegítésével járultak hozzá eredményeimhez. Középiskolai
tanáraimról, Horváth Sándorról és Halász Györgyről való megemlékezés után
egyetemi diplomáim témavezetőiről, Dr. Pályi Gyuláról és Dr. Lengyel Tamásról
szeretnék említést tenni. Első munkahelyemen, a Semmelweis Orvostudományi
Egyetem I.sz Kémiai és Biokémiai Intézetében Dr. Staub Mária útmutatásai
és Dr. Sasvári Mária segítsége meghatározó jelentőségűek voltak későbbi
tudományos pályafutásom során. Az elválasztás-tudomány alapjaiba Dr. Kalász
Huba és Dr. Nagy János vezettek be, igazi kutatóvá pedig Dr. Magyar Kálmán
akadémikus mellett váltam.
Csaknem két évtizede élek az Amerikai Egyesült Államokban, ahová mint
posztdoktori ösztöndíjas Dr. Benedek Kálmán ajánlásával kerültem ki. Amerikai
pályafutásomat Dr. Barry L. Karger laboratóriumában kezdtem, aki a mai
napig kitüntető figyelemmel kíséri szakmai fejlődésemet. Közvetlenül az
Amerikai Egyesült Államokba érkezésem után volt szerencsém megismerni a
Yale egyetemen Horváth Csaba professzort, az elválasztás-tudomány egyik
megteremtőjét, a HPLC atyját, aki egészen néhány hónappal ezelőtt bekövetkezett
hirtelen haláláig segítette tudományos fejlődésemet. Nagy megtiszteltetés,
hogy én vezethetem elsőként a róla elnevezett elválasztástudománnyal foglalkozó
intézetet Innsbruckban, a Horváth Institute of Bioseparation Science-t.
Külön köszönet illeti Dr. Günther Bonnt, aki ezen intézet megalapításában
nagy segítséget nyújtott.
Feltétlen köszönettel tartozom Dr. Görög Sándor, Dr. Pungor Ernő, Dr.
Kálmán Alajos, Dr. Benedek Pál és Dr. Hollósi Miklós akadémikusoknak, akik
tudományos pályafutásomat évtizedek óta figyelemmel kísérték és segítették.
Hálás köszönetemet fejezem ki Dr. Sperling Editnek amerikai kutatási hátterem
biztositásáért és Dr. Botka Saroltának magyarországi tudományos kapcsolataim
ápolásáért. Köszönettel tartozom továbbá Dr. Darvas Ferencnek magyarországi
utazásaim támogatásáért.
Végezetül az itt ismertetett kísérleti munkában közvetlenül is résztvevő
és segítő munkatársaimnak mondok köszönetet, akik nélkül ez az előadás
sem születhetett volna meg. Elsőként Magyarországról vendégprofesszorként:
Dr. Sasvári-Székely Mária, Dr. Rónai Zsolt, Dr. Takács László, Dr. Chován
Tibor, illetve akkor még doktoranduszként: Dr. Barta Csaba, Dr. Szőke Melinda,
Dr. Csapó Zsolt, Dr. Lengyel Timea, Dr. Gerstner Árpad, látogató és hosszabb
rövidebb időt laboratóriumomban töltő kollégáimnak. Természetesen köszönet
illeti amerikai munkatársaimat is: Dr. Julia Khandurina, Dr. Peter Domaille,
Dr. Aran Paulus, Mr. Robert Nelson, Mr. Eugene Berdichevsky, Dr. Bart Wanders,
Ms. Sarah Sandrick, Dr. Paul Budworth és Dr. Antonius Koller.
Irodalomjegyzék
Barta, C., Ronai, Z., Nemoda, Z., Szekely, A., Kovacs, E., Sasvari-Szekely,
M. and A.Guttman (2001). "Analysis of the Dopamine D4 receptor gene polymorphism
using microchip electrophoresis." Journal of Chromatography A. 924: 285-290.
Berdichevsky, Y., Khandurina, J., Guttman, A. and Y.H.Lo
(2004). "UV/ozone modification of poly(dimethylsiloxane) microfluidics
channels." Sensors and Actuators B. 97: 402-408.
Chovan, T. and A. Guttman (2001). Microfabricated reactor technology.
Integrated microfabricated biodevices. Eds.: M. Heller and A. Guttman.
New York, Marcel Dekker: pp 351-370.
Chovan, T. and A. Guttman (2002). "Microfabricated devices in biotechnology
and chemical processing." Trends in Biotechnology 20: 116-122.
Cohen, A. S., Najarian, D. R. Paulus, A. Guttman, A., Smith, J.A. and
Karger B.L. (1988). "Rapid separation and purification of oligonucleotides
by high-performance capillary gel electrophoresis." PNAS, Proceedings of
the National Academy of Sciences of the United States of America 85(24):
9660-9663.
Darvas, F., Guttman, A. and G. Dorman (2004). Chemical Genomics. New
York, Marcel Dekker.
Ganzler, K., Greve, K. S. Cohen, A.S., Karger, B.L., Guttman, A and
N.C.Cooke (1992). "High-performance capillary electrophoresis of SDS-protein
complexes using UV-transparent polymer networks." Analytical Chemistry
64(22): 2665-2671.
Guttman, A. (1996). "High-resolution carbohydrate profiling by capillary
gel electrophoresis." Nature (London) 380(6573): 461-462.
Guttman, A. (2000). Electric field mediated separation of bioplymers
on planar glass microchips. Planar Chromatography. Ed.: S. Nyiredy. Budkalász,
Res. Inst. Med. Plans.: pp 47-56.
Guttman, A. (2001). Integrated microfabricated device technologies
in chromatography. A century of discovery 1900-2000. Eds.: C. W. Gehrke,
R. L. Wixom and E. Bayer. Amsterdam, Elsevier: pp 200-205.
Guttman, A. (2003). "DNA sequencing: from capillaries to microchips."
Journal of Chromatography Library 68 (Emerging Technologies in Protein
and Genomic Material Analysis): pp 11-20.
Guttman, A., Horvath, J. and N. Cooke (1993). "Influence of temperature
on the sieving effect of different polymer matrixes in capillary SDS gel
electrophoresis of proteins." Analytical Chemistry 65(3): 199-203.
Guttman, A. and J. Khandurina (2003). Microfabricated bioanalytical
devices. Chromatography. Ed.: E. Heftmann. Amsterdam, Elsevier: pp 431-467.
Guttman, A., Khandurina, J. Ronai, Z., Sasvari-Szekely, M. and A. Guttman
(2003). "High throughput genotyping by microhip electrophoresis." Journal
of Capillary Electrophoresis 8: 77-80.
Guttman, M., Fules, P. and A.Guttman (2003) ”Rapid analysis of site-directed
mutagenesis constructs by capillary gel electrophoresis”, Journal of Chromatography
A 1014: 21-27.
Heller, M. and A. Guttman (2002). Integrated Microfabricated Biodevices.
New York, Marcel Dekker.
Karger, B. L., Cohen, A. S. and A. Guttman (1989). "High-performance
capillary electrophoresis in the biological sciences." Journal of Chromatography
492: 585-614.
Karger, B. L. and A. Guttman (2003). "Capillary electrophoresis and
the human genome project." Genomic and Proteomic Technology 3(3): 12, 14-16.
Karger, B. L., Snyder, L. R. and Cs.Horváth (1973). An Introduction
to Separation Science. New York, Wiley-Interscience.
Khandurina, J., Chovan, T. and A. Guttman (2002). "Micropreparative
fraction collection in microfluidic devices." Analytical Chemistry 74(7):
1737-1740.
Khandurina, J. and A. Guttman (2002). "Bioanalysis in microfluidic
devices." Journal of Chromatography A. 943: 159-183.
Khandurina, J. and A. Guttman (2002). "Microchip based high throughput
screening analysis of combinatorial libraries." Current Opinion in Chemical
Biology 6: 359-366.
Khandurina, J. and A. Guttman (2002). "Micromachined capillary cross-connector
for high-precision fraction collection." Journal of Chromatography, A 979(1-2):
105-113.
Khandurina, J. and A. Guttman (2003). "Microscale separation and analysis."
Current Opinion in Chemical Biology 7(5): 595-602.
Khandurina, Zhu, J., T. and A. Guttman (2003). Microchip based HTS
analysis of combinatorial libraries. Chemical Genomics. Eds.: F. Darvas,
A. Guttman and G. Dorman. New York, Marcel Dekker: pp 101-136.
Liu, S. and A. Guttman (2004). "Electrophoresis microchips for DNA
analysis." TrAC, Trends in Analytical Chemistry 23: 422-431.
Rathore, A. and A. Guttman (2003). Electrokinetic Phenomena: Principles
and Applications in Analytical Chemistry and Microchip Technology. New
York, Marcel Dekker.
Ronai, Z and A. Guttman, (2000) “Analytical and micropreparative capillary
gel electrophoresis of DNA fragments”, American Laboratory, 32: 28-31.
Ronai, Z., Barta, C. Sasvari-Szekely, M. and A. Guttman (2001). "DNA
analysis on electrophoretic microchips: effect of operational variables."
Electrophoresis 22(2): 294-299.
Rónai, Z., Sasvári-Székely, M., Chován, J. és A. Guttman (2002). "Elektroforetikus
mikrocsipek alkalmazása gyors DNS alanízisre." Biokémia 26: 26-32.
Vissza a tartalomjegyzékhez