Erdey-Grúz Tibor, mint az elektródfolyamatok kinetikájának úttörője és hatása az elektrokémia fejlődésére
Bevezető gondolatok
1992-ben J.O’M. Bockris (1923- ), a XX. századi elektrokémia egyik meghatározó személyisége a Nemzetközi Elektrokémiai Társaság (CITCE, majd 1971-től ISE) 1949-es alapítására visszaemlékezve így írt: „A túlfeszültséget, mint olyan betegséget tekintették, amelytől a gázelektródok szenvednek. Erdey-Grúzt és Volmert, akiket én az elektródfolyamatok kinetikája atyáinak tekintek, valamint Frumkint ritkán említették.” [1]. Ennél egyértelműbben kijelölni Erdey-Grúz Tibor (1902-1976) helyét az elektrokémia történetében mi sem tudnánk, sőt még a részrehajlás vádját is magunkra vonhatnánk, hiszen időnként ténylegesen szeretjük hozzájárulásukat nagyobbnak láttatni a tudomány egyetemes fejlődéséhez annál, mint amilyen független, külföldi tudománytörténészek értékítélete az adott területen. Különösen így van ez egy centenárium kapcsán, és e megemlékezés szerzőjének is be kell vallania, hogy nem is tud teljesen elfogulatlan lenni, hiszen Erdey-Grúz professzor irányításával készítette diplomamunkáját, és ő indította el a pályáján. Éppen ezért kezdtem Bockris megállapításával és fogok idézni másokat is bizonyítandó azt, hogy valóban nemcsak a magyar, hanem az egyetemes tudomány egyik kiemelkedő alakjáról emlékezünk ma meg.
Visszaadom a szót Bockrisnak, mert igen tanulságos az 1949-es helyzetet szemügyre venni. Az első mondatot érdemes eredetiben, angolul idézni: „The atmosphere and background of electrochemistry at this time was dominated by the dead hand of Nernst.” Mit jelent ez az igen kemény és tiszteletlen megállapítás? Miért volt probléma az, hogy a fizikai kémia egyik legnagyobb alakjának, Walther Nernstnek (1864-1941) „holt keze nehezedett az elektrokémiára”? (Talán érdekes azért is, mert a jelen megemlékezést a Magyar Tudományos Akadémián tartjuk, hogy Nernstet az MTA 1899. május 5-én választotta külső tagjává. Ugyanezen a napon lett Nernst tanítványa Bugarszky István (1868-1941) az MTA levelező tagja, aki nevét az endoterm galvánelemek felfedezésével írta be az elektrokémia történetébe. Ő a Budapesti Királyi Magyar Tudományegyetem II. számú Kémiai Intézetét vezette 1913-tól, míg Erdey-Grúz Buchböck Gusztávnál (1869-1935) a III. Kémiai Intézetben kezdett el dolgozni 1924-ben.) A kérdésekre a felelet röviden az, hogy a Nernst-féle egyensúlyi elektrokémia ekkor már túlhaladottá vált és gátolta az elektrokémia fejlődését. Meg kell jegyeznünk, hogy Nernst hozzájárulása az elektrokémiához óriási jelentőségű volt. Sajnálatosan azonban e tudományág termodinamikai megalapozása hibás fizikai képen alapult [2]. A Nernst-féle ozmotikus modell, az oldástenzió értelmetlen fogalmának bevezetése sok gond forrása lett. Arra találhatunk mentséget, hogy Nernst az elektronátmenettel járó, redoxireakciókat 1889-ben nem tudta értelmezni, hiszen J. J. Thomson csak 1897-ben igazolta az elektron létét, de arra már kevésbé, hogy Nernst 1941-ben bekövetkezett haláláig nem módosított az elméletén, rendkívül hátráltatva ezzel az elektrokémia fejlődését. A Nernst-féle elmélet születésének körülményei, utóélete és hatásának elemzése az utóbbi években megjelent munkákban [3-5] megtalálható. Tárgyunk tekintetében ezen ismeretek azért alapvető jelentőségűek, mert éppen Erdey-Grúz és Max Volmer (1885-1965) közleménye [6] ütötte a legnagyobb rést a nernsti elektrokémia szilárdnak tűnő építményén és nyitott utat az elektrokémia az elmúlt 50 évben bekövetkezett fejlődéséhez.
Az elektródfolyamatok kinetikájának megalapozása
Az elektródfolyamatok sebességének mérése igen egyszerű, hiszen az áramot (I) kell csak mérni, vagy hogy pontosabbak legyünk – lévén szó heterogén reakcióról – az áramsűrűség (j) ad egyértelmű felvilágosítást egy adott reakció sebességéről. Az elektrokémiában még az a különleges lehetőségünk is megvan, hogy állandó reakciósebességet (áramsűrűséget) állítsunk be. A korai mérések általában így is történtek, azaz az áramsűrűség függvényében mérték a potenciált. A galvanosztatikus módszert (j = állandó) csak a potenciosztát kifejlesztése (A. Hickling, 1942.) után kezdték felváltani a potenciosztatikus, illetve a potenciáldinamikus mérési technikák. Talán nem volt igazán szerencsés az, hogy a galvanosztatikus módszer nyert teret, ugyanis a reakciókinetika szemléletének jobban megfelel az, hogy a reakciósebesség (ez esetben az áram) függvénye különböző tényezőknek. Az elektrokémiai méréseknél a szokásos paramétereken (hőmérséklet, koncentráció) kívül megjelenik a fázishatáron fellépő potenciálkülönbség, az elektródpotenciál (E), sőt már az is korán nyilvánvalóvá vált, hogy ez az utóbbi mennyiség a meghatározó az áram nagysága, illetve a termékeloszlás (F. Haber, 1900.) tekintetében. Mindenki nagyjából elfogadta az elektródpotenciál Nernst-féle értelmezését, tehát azt a felfogást, hogy a potenciál ellentétes irányú, végső soron egyensúlyi, anyagátlépéssel járó folyamatok eredményeként jön létre. Ez a modell többé-kevésbé megfelelő volt olyan galvánelemeknél, amelyeknél fémoldódás / fémionleválás történik, de nem alkalmazható redoxielektródok, ideálisan polarizálható elektródok, illetve irreverzibilis elektródreakciók esetén. Érdekes jelenségnek lehetünk tanúi, a kutatók használtak egy fogalmat, amelyik praktikus volt, de igazából nem törődtek az egyre nyilvánvalóbbá váló ellentmondásokkal. Jellemző példa, hogy szerves vegyületek elektrolízisénél szóba sem jöhet a Nernst-féle elmélet, pedig ez a XIX. században és a XX. század elején széleskörűen, főleg preparatív céllal művelt terület volt. Az első jelentős összefüggés felismerése is egy szerves kémikus, J. Tafel (1862-1918) nevéhez fűződik, aki E. Fischer tanársegédje volt. Tafel az áramsűrűség és a túlfeszültség (az egyensúlyi potenciáltól való eltérés mértéke: h= E – Ee) között az alábbi kapcsolatot állapította meg:
![]() (1)
(1)
ahol a és b állandók [7].
Tafel azt gondolta, hogy a hidrogénfejlődésnél a H2 – molekula képződése (2H® H2) a lassú folyamat. Ebből az értelmezésből adódó következtetések, a b állandóra kapott értékek azonban általában nem egyeztek a tapasztalattal. Noha az 1920-as években R. B. Audubert (1892-1957), J. A. V. Butler (1899-1977) és J. Heyrovsky (1890-1967) már kinetikai elméleti alapon kísérelte meg értelmezni a túlfeszültséget, az igazi áttörést Erdey-Grúz és Volmer 1930-as közleménye [6] hozta meg. Nézzük meg, hogyan ír maga Erdey-Grúz Tibor erről kiváló könyvében [8] 39 évvel később: „Az elektródfolyamatok elméletének kibontakozása Erdey-Grúz és Volmer azon felismeréséből indult ki, hogy e folyamatok a reakciókinetika törvényei alapján vizsgálandók, és az elektrolitikus hidrogéntúlfeszültséget (a nagy túlfeszültségű elektródokon) a hidrogénionok semlegesítésének a lassú volta okozza. A semlegesítés lassúsága viszont e folyamat nagy aktiválási energiájára vezethető vissza, amely a túlfeszültség révén csökkenthető. Az általuk bevezetett és máig is használt átlépési faktor lehetővé teszi a kísérleti adatok értelmezését az aktivált állapot (átmeneti komplexum) részletes ismerete nélkül.”
Az egyik döntő megfigyelés az volt, hogy a túlfeszültség közvetlenül az áram bekapcsolása után nem logaritmikusan, hanem lineárisan nő a töltés mennyiségével (F. P. Bowden és E. K. Riedel, 1928., E. Baars, 1928., H. Brandes, 1929., T. Erdey-Grúz és G. G. Kromrey, 1930-31.). Ebből pedig az következik, hogy azoknál az elektródoknál, amelyeknél b értéke 0,12 körüli, a hidrogénionok semlegesítése a gátolt folyamat, hiszen a lineáris változás csak a hidrogénionoknak az elektrokémiai kettős rétegben való feldúsulásával magyarázható. A kor csúcstechnológiáját jelentő oszcilloszkópos mérések során nyert, szép oszcillografikus felvételek a [6] közleményben megtekinthetők.
A kinetikai megfontolások alapján kapott összefüggés, amelynek segítségével a mért j – E függvények gátolt töltésátlépés esetén leírhatók, amely magyarázatot ad az empirikus Tafel-egyenletre először jelenik meg a szakirodalomban. Nagy túlfeszültségre, amelyre a Tafel-egyenlet is vonatkozik, a következő egyenletet vezették le:
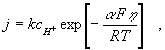 (2)
(2)
amiből azonnal látszik, hogy logaritmikus alakban és átrendezve a Tafel-egyenlethez
jutunk, és a b állandó is értelmet nyer, hiszen ![]() Ugyanekkora jelentőségű az egyensúly közeli állapotokra vonatkozó egyenlet
– amely más rendszerekre is általánosítható és amely az elektródreakciók
kinetikájának alapegyenlete ma is – hiszen ez az egyensúlyi (reverzibilis)
potenciál (Er) első kinetikai (nem termodinamikai) levezetése:
Ugyanekkora jelentőségű az egyensúly közeli állapotokra vonatkozó egyenlet
– amely más rendszerekre is általánosítható és amely az elektródreakciók
kinetikájának alapegyenlete ma is – hiszen ez az egyensúlyi (reverzibilis)
potenciál (Er) első kinetikai (nem termodinamikai) levezetése:
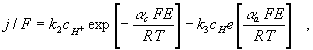 (3)
(3)
egyensúlyban j = 0, E = Er.
Ezzel az eredménnyel megszületett az elektródfolyamatok kinetikájának tudományos elmélete, és megnyílt az út a korszerű elektrokémiai fejlődése előtt. Annak okára már korábban kitértünk, hogy az igazi áttörésre, a paradigmaváltásra miért is kellett még több, mint 20 évet várni.
A németországi kutatások és hatásuk Erdey-Grúz Tibor tudományos pályájára
Erdey-Grúz Tibor a legjobb helyre ment tanulmányútra és a legjobb időben, hiszen ekkor Németország volt a tudomány központja a világban. Max Volmer berlini laboratóriuma is igen jó választásnak bizonyult. A katódos fémleválasztásról szóló cikkük [9] is mindmáig alapműnek számít. (Max Volmer W. Ostwaldnál és M. Le Blancnál tanult a Lipcsei Egyetemen, az utóbbinál habilitált 1913-ban fényelektromosság témában. Dolgozott Nernst intézetében is, kiváló munkái jelentek meg a termodinamika, az adszorpció, a diffúzió, a fázisátalakulások és más témákban. Mégis leginkább az elektrokémia kiválóságai között tarthatjuk őt számon. A náciktól távol tartotta magát, de nem kerülhette el számos más német tudós sorsát. 1945-ben őt is a Szovjetúnióba „invitálták”, ahol 10 évig a Gustav Hertz vezette titkos intézetben más német hadifogoly tudósokkal együtt atomkutatással foglalkozott. 1955-ben térhetett haza, ahol a berlini Humboldt Egyetemen lett professzor. 1956. és 1958. között az NDK Tudományos Akadémiájának elnöke volt.)
A hároméves (1928. október - 1931. szeptember) németországi tanulmányút rendkívül sikeres volt. A hidrogéntúlfeszültség [6, 10], valamint a fémelektródok és az elektrokristályosodás [9, 11, 12, 13, 14, 15] tanulmányozása mellett adszorpciós kutatásokat [16] is végzett. (Ez utóbbit Fajans müncheni intézetében.) Hazatérve a következő négy évtizedben az elektródfolyamatok kinetikájának vizsgálata Erdey-Grúz Tibor kutatásainak egyik központi témája lett, a már korábban elkezdett elektrolitoldatokban végbemenő transzportfolyamatok tanulmányozása mellett. A teljesség kedvéért meg kell említenünk az elektrokémiai hidrogénezéshez szorosan kapcsolódó katalitikus folyadékfázisú hidrogénezéssel kapcsolatos munkásságát [17], valamint az anyagszerkezet iránti érdeklődését is. Minden említett területen az ő kezdeményező tevékenysége folyományaként alakultak meg azok a tudományos iskolák, amelyek ma is meghatározó szerepet játszanak a hazai kémiai kutatásban.
Az elektródfolyamatok kinetikája tekintetében a váltóáramú mérések és az oxigéntúlfeszültséggel kapcsolatos vizsgálatok képezték tevékenysége fő vonulatát 1950. és 1976. között. A részletes hivatkozások és a téma összefoglalása az említett, nagysikerű könyvében [8] találhatók meg. Az első témában több, mint 40, míg a másodikban több, mint 20 közlemény jelent meg Erdey-Grúz Tibor szerzőségével. Némileg sajnálatos, hogy ezek gyakorlatilag mind magyar nyelvű folyóiratokban, illetve az Acta Chimica-ban jelentek meg, így a hatásuk nem mondható jelentősnek. Klasszikus cikkei mellett érdemi mennyiségű hivatkozást csak könyvének angol és német kiadása hozott. Sajnos a nemzetközi kapcsolatok beszűkülése az 1950-es és az 1960-as években sem kedvezett e munkák megismertetésének. Ezt némileg pótolta a kiváló kelet-európai iskolákkal (Frumkin, Heyrovsky, Kemula) való kapcsolattartás.
Erdey-Grúz Tibor munkásságának visszhangja, a Butler-Volmer egyenlet problémája
Az elektródfolyamatok kinetikájának alapegyenletét, amelyet Erdey-Grúz Tibor és Max Volmer vezetett le, az újabb szakirodalom Butler-Volmer-egyenletként említi. Sajnos a tudománytörténetben számos olyan példát találunk, amikor egy elmélet, egyenlet névadását személyes ambíciók, csoportérdekek vagy a nemzeti nagyság bizonyítása befolyásolja. Ismert, hogy a Boyle vagy Boyle-Mariotte-törvényt tulajdonképpen Towneley és Power vezette le, a Gay-Lussac-féle törvényt angol nyelvterületen Charles-törvénynek hívják vagy, hogy Beernek sincs igazán köze a fényelnyelés róla elnevezett törvényéhez. Különös, hogy éppen Bockris, aki messzemenően elismerte Erdey-Grúz és Volmer szerepét, volt az, aki először cserélte fel Erdey-Grúz nevét Butleréra. 1967-es könyvében [18] Butler még nem szerepel. Következő könyvében [19] bevezeti Butler nevét, de megjegyzi, hogy az áramsűrűség potenciálfüggésére Butler csak egy kezdetleges nézetet fejtett ki, és az adekvát leírás Erdey-Grúz és Volmer cikkében jelenik meg először. 1977-es könyvében [20] is még Butler-Volmer- Erdey-Grúz elméletéről ír, amely 1950-től meghatározta a Nernst utáni elektrokémiát. Talán később a három nevet túl soknak ítélte. Azóta a tankönyvírók, illetve a közlemények szerzői – tudjuk, hogy a domináns irodalom angol nyelvű – egyszerűen átvették ezt a helytelen gyakorlatot. Elég reménytelen, de folytatjuk az eredeti, jogos elnevezés visszaállításáért való küzdelmet különböző nemzetközi fórumokon. Be kell vallanom, hogy egyelőre mérsékelt eredménnyel, de azért vannak támogatók. Így például Robert de Levie is egyértelműen kiáll Erdey-Grúz mellett [21]. De Levie a következőt írja: „ Butler jelentős angol elektrokémikus volt, és valóban foglalkozott a problémával. S bár utólag nyilvánvalónak tűnhet, hogy az alkalmazott potenciált ketté kell választani egy redukciót és egy oxidációt támogató részre, Butler erre nem jött rá. Az elektrokapillaritásról írt 1940-es könyvében [22] Butler Erdey-Grúzra és Volmerre hivatkozik.” Bockris újabb könyvének [23] 3.3.1 fejezete a „The Butler-Volmer Equation” címet viseli, de az első mondat így hangzik: „That an exponential relation exists between the shift of the electrode potential from that corresponding to equilibrium to that corresponding to a given rate was established experimentally by Tafel and rationalized properly for the first time by Erdey-Grúz and Volmer in 1930.”
Butler nevét és szerepének leírását, amely a prioritását indokolná, sehol sem találhatjuk Bockrisnál. Általában Butlernek egy 1924-es cikkére [24] szoktak hivatkozni, de ezzel kapcsolatban de Levie véleményével kell egyetértenünk. A német nyelvű irodalomban – ilyen ma már kevés van – Erdey-Grúz és Volmer szerepel, bár itt érthetően (?) Volmert emelik ki egyes esetekben, azzal az indokkal, hogy ő volt a szenior kutató. Az orosz nyelvű szakirodalomban [25] is sajátos megfogalmazást találhatunk: „ A lassú töltésátlépés első kvalitatív megfogalmazását M. Volmer és T. Erdey-Grúz 1930-as munkájában találhatjuk. Ugyanakkor ők nem jutottak el az elektrokémiai kettős réteg szerepének felismeréséhez, amely lényeges hiányosságot A. N. Frumkin elmélete oldotta fel.” Igazuk van Frumkin szerepét illetően, de azért a megfogalmazásból kitűnik, hogy kinek mi a fontosabb. Mindazonáltal Erdey-Grúz és Volmer elmélete teljesen helytálló, és természetes az is, hogy a kezdeti, nagy lépést még sok fontos felismerés követte. Magyar vonatkozása miatt is érdemes megemlíteni, hogy az átlépési tényező első elméleti értelmezése Polányi Mihály Horiutival írt közleményében [26] jelenik meg.
Erdey-Grúz Tibor munkásságának jelentőségét nehéz lenne túlértékelni. Sokunkat, akik jelen vagyunk most, hogy születésének 100. évfordulóján tisztelegjünk a nagy tudós emléke előtt, ő segített pályánkon elindulni személyesen vagy azáltal, hogy kitűnő könyveiből tanulhattunk. Az, hogy a magyar elektrokémia tekintélyt vívott ki a világban, nagymértékben neki köszönhetjük, az ő eredményeinek, valamint annak a tevékenységének, amellyel tanítványait kinevelte, akik a hazai egyetemeken és kutatóintézetekben létrehozták a ma is működő elektrokémiai és katalitikus kutatócsoportokat. Az egyre bővülő ismeretek és az új csillagok a tudomány egén a természet rendje szerint halványítják az elődök emlékét és munkásságát, de nem lehet kétségünk, hogy az elektrokémia történetének lapjain ennyi biztosan mindig szerepelni fog: Erdey-Grúz Tibor és Max Volmer az elektródfolyamatok kinetikája elméletének kidolgozói, 1930.
Irodalomjegyzék
[1] Bockris, John O’ M.: The Founding of the International Society
for Electrochemistry. Electrochimica Acta 1992. 36, 1-4. p.
[2] Nernst, Walter: Die elektromotorische Wirksamkeit der Ionen.
Zeitschrift für physikalische Chemie. 1899. 4. 129-181. p.
[3] Horányi György: Egy téves modell szerepe a fizikai kémia és
az elektrokémia kialakulásában. 1990. 71-73. p.
[4] Inzelt György: Az elektrokémia korszerű elmélete és módszerei
2. kötet, Bp. 1999. Nemzeti Tankönyvkiadó 272-297. p.
[5] Inzelt György: Hibás a modellje Einstein professzor! Természet
Világa 2001. 7. 290-293. p.
[6] Erdey-Grúz, Tibor und Volmer, Max: Zur Theory der Wasserstoffüberspannung.
Zeitschrift für physikalische Chemie 1930. A150. 203-213. p.
[7] Tafel, Julius: Über den Verlauf der elektrolytischen Reduktion
schwer reduzierbarer Substanzen in schwefelsaurer Lösung. Zeitschrift
für physikalische Chemie 1900. 34. 187-228. P.
[8] Erdey-Grúz Tibor: Elektródfolyamatok kinetikája. Bp. 1969.
Akadémiai Kiadó. 16. p.
[9] Erdey-Grúz Tibor és Volmer, Max: Zur Frage der elektrolytischen
Metallüberspannung. Zeitschrift für physikalische Chemie 1931. A157.
165-181. p.
[10] Erdey-Grúz, T., Wick, H.: Zur Frage der Wasserstoffüberspannung.
Z.physik. Chem., 1932. A 162, 53-62. p.
[11] Erdey-Grúz, T., Kromrey, G.G.: Über die Polarisationskapazität
von Quecksilber-elektroden. Z.physik. Chem. 1931. A 157, 213-241. p.
[12] Erdey-Grúz, T., Volmer, M.: Überschreitungserscheinungen bei
der elektrolytischen Metallabscheidung. Z.physik. Chem., 1931. A 157,
182-187. p.
[13] Erdey-Grúz, T., Wick, H.: Die Abscheidungsspannung des Quecksilbers
an Fremd-elektroden. Z.physik. Chem., 1932. A 162, 63-70. p.
[14] Erdey-Grúz, T.: Über das elektrolytische Wachstum der Metallkristalle.
Naturwissenschaften, 1933. 21, 799-800. p.
[15] Erdey-Grúz, T.: Über das elektrolytische Wachstum der Metallkristalle,
I. Wachstum von Silberkristallen aus wässerigen Lösungen. Z.physik.
Chem., 1935. A 172, 157-187. p.
[16] Fajans, K., Erdey-Grúz, T.: Über die Adsorption von Ionen,
insbesondere der Radioelemente und Farbstoffe an salzartigen Verbindungen.
Z.physik. Chem., 1932. A 158, 97-151. p.
[17] Erdey-Grúz, T.: Rate of hydrogenation in solutions and the
mass of the catalyst. Nature, 1949. 163, 256-257. p.
[18] Bockris, J. O’ M. and Razumney, G.A.: Electrocrystallization.
1967. Plenum, New York. 11. p.
[19] Bockris, J. O’ M. and Reddy, Amulya K.N.: Modern Electrochemistry.
1970. Plenum , New York.
[20] Bockris, J. O’ M., Rand, D. A. J. and Welch, B. J.: Trends
in Electrochemistry. 1977. Plenum. 10. p.
[21] De Levie, Robert: What’s in a name? Journal of Chemical
Education. 2000. 77. 610-612. p.
[22] Butler, J.A.V.: Electrocapillarity. 1940. Methuen, London.
p. 132.
[23] Bockris, J. O’M. and Khan, S.U.M.: Surface electrochemistry,
1993. Plenum, New York, 213. p.
[24] Butler, J.A.V.: Trans. Faraday Soc. 1924. 19. 729-734.
p.
[25] Damaszkin, B.B., Petrij, O.A.: Vvegyenyije v elektrohimicseszkuju
kinetiku. 1975. Vüzsaja skola. 243. p.
[26] Horiuti, Juro és Polányi, Mihály: Acta Physicochim, USSR,
1935. 2. 505. p.
Summary
Inzelt, György: Erdey-Grúz Tibor as the pioneer of kinetics of electrode processes and his influence on the development of electrochemistry
On the occasion of the centenary of the birth of Professor Tibor Erdey-Grúz (1902-1976) his outstanding contribution to the development of the modern electrochemistry, especially to the foundation of electrode kinetics is surveyed. A comparison is made between the Nernstic and the contemporary electrochemistry originated from the pivotal work of T. Erdey-Grúz and M. Volmer that appeared in 1930. The use of the name of Butler - Volmer equation which is the recent practice in the English language literature is criticized, since in the light of the historical facts it should be called Erdey-Grúz – Volmer equation.
<