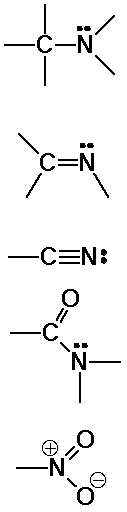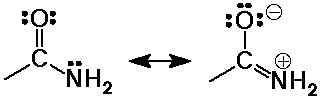12. fejezet
Aminok
Nitrogéntartalmú szerves vegyületek
- több funkciós csoport, beleértve az oxigént
is tartalmazó csoportokat
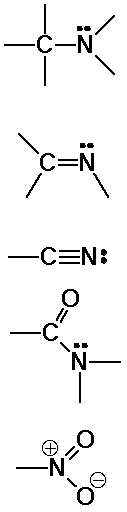 |
aminok |
| iminek |
| nitrilek |
| amidok |
| nitrocsoport |
Az aminok osztályozása
- primer (1o) - a N-hez egy C kapcsolódik
- szekunder (2o) - a N-hez két C kapcsolódik
- tercier (3o) - a N-hez három C kapcsolódik
- kvaterner (4o) - a N-hez négy C kapcsolódik
(pozitív töltés)
- vegyük észre a különbséget a többi
funkciós csoporthoz képest, melyeket a funkciós csoporthoz
kapcsolódó C szerint osztályozunk.
(CH3)3C–NH2 (primer amin)
(CH3)3C–OH (tercier alkohol)
Az aminok nómenklatúrája
- IUPAC: amino-szubsztituens
- triviális: alkil-amin
- Chemical Abstracts: alkanamin
 |
1-amino-penán
pentil-amin
1-pentán-amin |
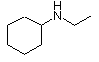 |
ciklohexil-etil-amin
(etil-amino)-ciklohexán
N-etil-ciklohexán-amin |
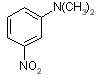 |
N,N-dimetil-m-nitroanilin |
Az aminok szerkezete
- a nitrogén a magános párjával sp3
(tetraéderes)

- a poláris csoportok a kisebb aminokat vízoldhatóvá
teszik, hidrogénkötés
Az aminok bázicitása, az ammóniumionok savassága
- a N magános elektronpárja könnyen protonálódik
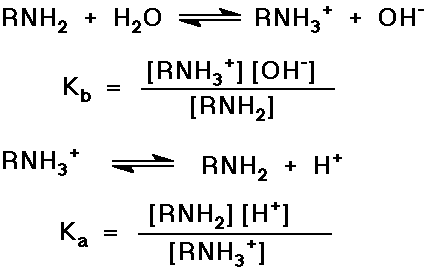
- vegyük észre, hogy Kb x Ka = [H+]
[OH-] = Kw = 10-14
vagy pKa + pKb = 14
- emlékezzünk rá, ha pH = pKa , a konjugált
sav és a konjugált bázis azonos koncentrációban
van jelen (pl. RNH2 és RNH3+ )
- tipikus alifás aminokra: pKb = 3 - 4
így pKa = 10 - 11 az ammóniumionokra,
ezért pH 10 - 11 körül az RNH2 és az
RNH3+ is jelen van
- tipikus aromás aminokra: pKb = 9 - 10
így pKa = 4 - 5 ammóniumionjaikra,
ezért pH 4 - 5 körül, az ArNH2 és az
ArNH3+ is jelen van
- az aminok vízoldhatósága könnyen változtatható
a pH-val
az aromás aminok vízoldhatók (protonáltak)
pH 4 alatt
az alifás aminok vízoldhatóak (protonáltak)
pH 9 alatt
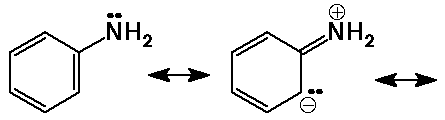
Bázicitási tendencia
- az aromás aminok kevésbé bázikusak a N
magános elektronpárjának rezonancia okozta delokalizálódása
miatt
- az amidok nem bázikusak a magános elektronpár
erõs delokalizálódása miatt
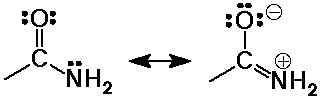
- az elektronvonzó effektus csökkenti a bázicitást,
mert a N magános elektronpárja kevésbé képes
a proton megkötésre
Optikai rezolválás
- egy királis amin racém elegye királis savval szétválasztható
enantiomerekre
pl. a természtetes tejsav vagy citromsav
- az amin-sav sók (ammónium-karboxilátok) diasztereomerek
és így különbözõ tulajdonságaik
miatt elválszthatók
Aminok elõállítása
- szubsztitúciós reakcióval:
ammónia SN2 reakciója alkil-halogenidekkel,
az amin termék továbbra is nukleofil, ezért gyakran
játszódik le további szubsztitúció is;
primer aminokat nagy fölöslegû NH3-val nyerhetünk,
így elkerülve a további szubsztitúciót
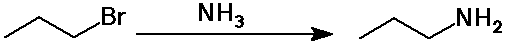
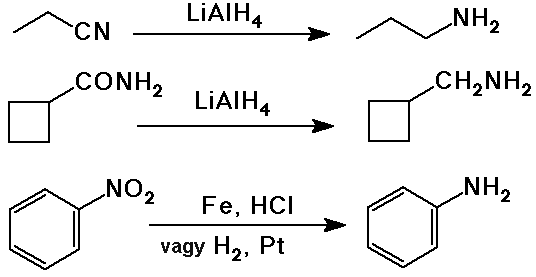
Aminok reakciói
- szubsztitúciós reakciók:
SN2 reakció alkil-halogenidekkel
kvaterner sók elõállításán kívül
a túlalkilezõdés mindig probléma
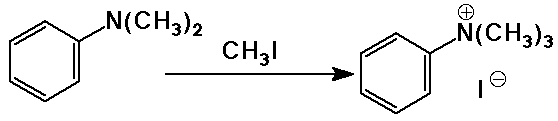
- acil-szubsztitúció amidok elõállítására
(általában-savkloriddal)
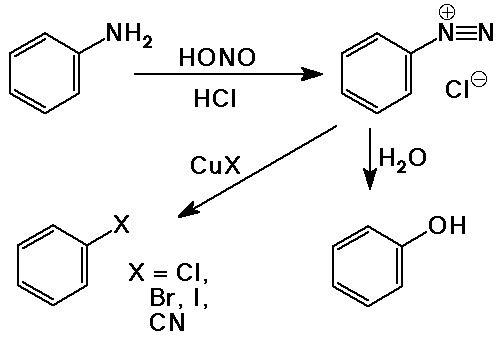
Diazóniumsók
- primer aminok reagálnak HNO2-vel (salétromossavval)
- az aril-diazónium-ionok viszonylag stabilak, de nukleofilekkel
lecserélhetõk
ezen az úton lehetséges nukleofilek kapcsolása az
aromás gyûrûhöz
emlékezzünk rá, hogy a legtöbb aromás szubsztutúció
elektrofil volt
- Sandmeyer-reakció - a diazóniumiont CuX katalizátorral
ArX vegyületté alakítja
Pirrol
- öttagú heterociklusos gyûrû
- aromás, mert hat ¶ elektron van (beleértve a N magános
elektronpárját)
a pirrol nem bázikus a magános elektronpár aromaticitásban
történõ részvétele miatt
- a pirrol a benzolnál is reaktívabb aromás elektrofil
szubsztitúcióban
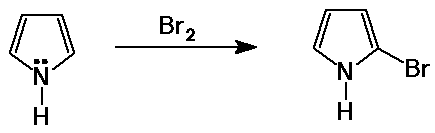
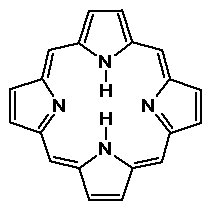
- a hemben és a klorofillben található porfiringyûrû
tetrapirrol
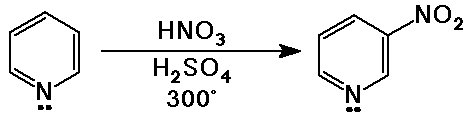
Piridin
- 6 tagú heterociklusos gyûrû
- aromás a 6 ¶ elektron miatt (3 kettõs kötés)
a piridin bázikus, mert a N magános elektronpárja
szabad
- a piridin a benzolhoz képest kevéssé reaktív
aromás elektrofil szubsztitúcióban
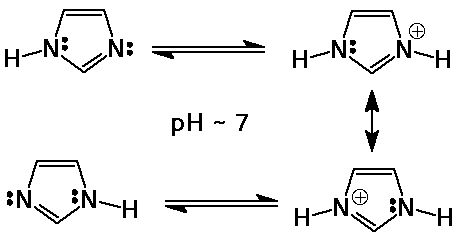
Imidazol
- öttagú heterociklusos gyûrû két N atommal
- az egyik N magános elektronpárja szabad (bázikus)
az imidazol pKb-je 7 körüli
általános sav- (és bázis-) katalizátor
a biológiai rendszerekben 7 körüli pH-n
Alkaloidok
- természetben elõforduló aminok, mint pl. a morfin
az alkaloid elnevezés bázikus tulajdonságukból
származik
Ismeretanyag
- aminok elnevezése, illetve név alapján szerkezetük
megadása
- aminok csoportosítása (primer, szekunder vagy tercier)
- pKa és/vagy pKb értékek
felhasználásával az aminok ionizáltságának
becslése különbözõ körülmények
között
- sav-bázis reakciók használatának illusztrálása
racém keverékek optikai rezolválásában
- aminok elõállítása szubsztitúciós
vagy reduktív úton
- diazóniumionok elõállítása és
alkalmazása aromás szintézisekben
- pirrol, piridin, és imidazol megkülönböztetése
szerkezetük és sav-bázis kémiájuk alapján
Vissza