A fordítás Ronald J. Gillespie írása alapján készült (Covalent and Ionic Molecules: Why Are BeF2 and AlF3 High Melting Point Solids whereas BF3 and SiF4 Are Gases?, Journal of Chemical Education, 1998., 75. k., 7. sz., 923.–925. o.), a JCE engedélyével. A Journal of Chemical Education lapjai a http://jchemed.chem.wisc.edu/ címen érhetõk el.
A tankönyvekben általában azzal a feltevéssel élnek, hogy a gázfázisú molekulák a szobahõmérséklet közelében elsõsorban kovalens kötésûek. Felteszik tehát, hogy a BF3 és a CF4, amely szobahõmérsékleten gáz, fõként kovalens molekulákból áll, míg a LiF és a BeF2, amely szobahõmérsékleten kristályos szilárd anyag, ionos kötésû. Ugyanezzel a meggondolással a szobahõmérsékleten kristályos szilárd anyagként ismert, 3. periódusbeli NaF-ot, MgF2-ot és AlF3-ot ionos kötésûnek tartják, míg a gáz alakú SiF4-ot fõként kovalensnek. A BF3, SiF4 és a hasonló molekulák kötéseit rendszerint poláros kovalens kötésnek tekintik, de az atomokon levõ töltést általában elég kicsinek tartják. Mivel az elektronegativitás növekszik a periódusok mentén, azt várjuk, hogy a fluoridok kötéseinek ionos jellege fokozatosan csökkenjen egy-egy perióduson belül. Ezért az ionos kötés hirtelen kovalensre válása a BeF2-ról a BF3-ra, illetve az AlF3-ról a SiF4-ra áttérve meglepõ.
| 1. táblázat. Atomi töltések
fluoridok esetében |
||
| Molekula | –q(F) | q(A) |
| LiF | 0,94 | 0,94 |
| BeF2 | 0,91 | 1,81 |
| BF3 | 0,87 | 2,58 |
| CF4 | 0,74 | 2,96 |
| NF3 | 0,36 | 1,09 |
| OF2 | 0,12 | 0,23 |
| F2 | 0 | 0 |
| NaF | 0,94 | 0,94 |
| MgF2 | 0,91 | 1,83 |
| AlF3 | 0,88 | 2,65 |
| SiF4 | 0,86 | 3,42 |
| PF3 | 0,84 | 2,51 |
| SF2 | 0,71 | 1,43 |
| ClF | 0,50 | 0,50 |
Ezért a BF3 és a SiF4 leginkább ionos molekulának tekinthetõ, amelynek központi, kationszerû atomját szoros illeszkedésû, anionszerû ligandumok veszik körül – három trigonális planáris elrendezésben a BF3-ban, négy tetraéderes elrendezésben a BF4– -ben és az SiF4-ben és hat oktaéderes elrendezésben az SiF62– -ban. Az SiF62– SiF4-nél hosszabb kötései (169,4 pm a 155,5 pm-hez képest) ugyancsak összahangban vannak a szoros illeszkedésû modellel (1).
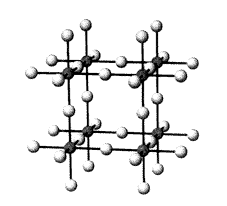
1. ábra. Az AlF3 kristályszerkezete.
A sötét körök jelzik az alumíniumatomokat, a világosak a fluoratomokat
Miért nem képeznek akkor ezek a molekulák ionos kristályt? Az 1. ábra az AlF3 kristályszerkezetét mutatja, amelyben minden alumíniumatomot hat fluoratom koordinál oktaéderesen, és minden fluoratomot két aluminíumatom koordinál lineárisan, tehát végtelen háromdimenziós szerkezet alakul ki. Általában ahhoz, hogy egy MFn fluorid háromdimenziós végtelen rácsot alkosson, minden fluoratomnak legalább kétszeres koordinációra van szüksége, tehát minden M atomot 2n fluoratomnak kell koordinálnia (3). A bór maximális koordinációs száma azonban, mint minden más, 2. periódusbeli elemnek, ismereteink szerint minden molekulájában négy, mert a nagyobb koordinációs számhoz túl kicsi a bóratom. Ha hat fluorligandumot akarnánk a bór körül elhelyezni, a kötések sokkal hosszabbak lennének, mint a BF4– -ben, és valószínûleg túl gyengék lennének ahhoz, hogy a molekula ne bomoljon el. Ezért a BF3 nem alakíthat ki olyan háromdimenziós ionos szerkezetet, mint az AlF3, és megtartja molekulaszerkezetét, bár molekulái meglehetõsen ionosak. Ezzel szemben a BeF2-nak végtelen háromdimenziós szerkezete van, mert a kristályban a berillium csak négyes koordinációjú (2. ábra). Bár az AlF3 végtelen háromdimenziós kristályszerkezettel rendelkezik, amelyben az Al 6-os koordinációjú, a SiF4 esetében nem alakulhat ki végtelen háromdimenziós szerkezet, mert a szilíciumnak 8-as koordinációra lenne szüksége, és ehhez a szilícium túl kicsi. A BF3-hoz hasonlóan tehát a SiF4 is molekuláris alakban jelenik meg, bár a SiF kötés erõsen ionos jellegû. Egy AF4 fuorid csak akkor lehet 8-as koordinációjú és akkor alkothat háromdimenziós, végtelen kristályszerkezetet, ha az AF4 molekulában az A jelentõsen nagyobb, mint a szilíciumatom; jó példa erre a ZrF5 (6).
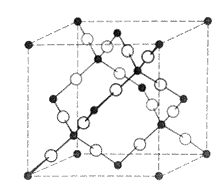
2. ábra. A BeF2 kristályszerkezete.
A betöltött körök jelzik a berilliumatomokat, az üresek a fluoratomokat
Azt, hogy a BF3 BF kötései rövidek (130,7 pm) a bór és fluor kovalens rádiuszainak összegéhez (145 pm) (7) és a BF4– ion kötéseihez (139,6 pm) képest, a szervetlen kémiai tankönyvek rendszerint annak tulajdonítják, hogy a BF3-ban a BF kötések részlegesen kettõs kötés jellegûek. Ezt pedig azzal magyarázzák, hogy a fluor magányos elektronpárt ad az üres 2px pályára, amint az 1. rezonanciaszerkezet vázolja.
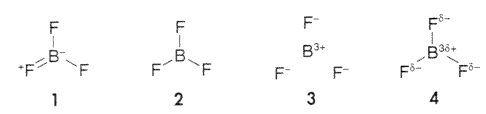
Ez a modell azonban több esetben is helytelen eredményre vezet (1), és a számított töltésekkel sincs összhangban. Sokszor azt mondják, hogy a hagyományos 2. szerkezettel jellemzett BF3 kivétel az oktett-szabály alól. Ha azonban a BF3-ot ionos molekulának tekintjük, mint a 3. vázlaton, az oktett-szabály nem sérül, mert mind a B3+, mind a F– elektronszerkezete nemesgáz-konfigurációjú. Ezenkívül az anionszerû fluorligadumok szoros illeszkedése a kationszerû bóratom körül összhangban van a BF3 és BF4– kötéshosszainak különbségével.
A BF3 leírására szinte általánosan elfogadott 2. szerkezet vagy az 1-hez hasonló rezonanciaszerkezetek alátámasztják azt a gyakori véleményt, hogy a BF3 fõként kovalens molekula. Még a parciális töltéseket feltüntetõ 4. vázlat is ezt a benyomást kelti, mert a vonal mindig kovalens töltésre utal, a d+ és d– jel pedig kis töltéseket érzékeltet, jelezvén, hogy a kötés poláros, de közelebb van a kovalens jelleghez. Valójában a BF3 molekulában a kötés sokkal inkább ionos jellegû, így a 3. modell sokkal jobb közelítés a másik háromnál. A rövid kötéshossz és a nagyon nagy kötési energia (613 kJ·mol–1) (8) a nagy töltésû B és F atomok közötti erõs vonzásnak, tehát a kötések erõs ionos jelelgének tulajdonítható.
A SiF4 molekula hasonlóképpen ionos szerkezettel jellemezhetõ. A kovalens ráduszok összegéhez (181pm) képest tapasztalható kis kötéshossz (155,5 pm) (7) és a nagy kötési energia (565 kJ·mol–1) (8) ismét a kötések domináns ionos jellegének tudható be. Az 1. táblázatból látható, hogy az A és F töltéseinek szorzata a B és a Si esetében a legnagyobb; ez megfelel annak, hogy a BF és a SiF kötések a legrövidebb és a legerõsebb kötések a 2., illetve a 3. periódus fluoridjai közül.
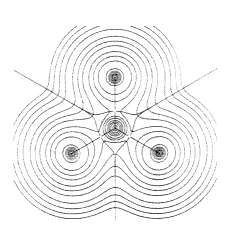
3. ábra. A BF3 molekula elektronsûrûség-eloszlásának metszete. A szintvonalakra merõleges vonalak mentén az atomokat szétválasztó interatomos (zérus fluxusú) felületek metszik a molekula síkját. Az atommagokat összekötõ vonal mentén az elektronsûrûség nagyobb, mint bármely olyan vonal mentén, amely az összekötõ vonalra merõleges
Elektronsûrûség-eloszlások
és atomi töltések
A 3. ábrán láthatók a számított
elektronsûrûség-eloszlások a BF3 molekula
síkjában (a vonalak az azonos elektronsûrûségû
helyeket jelölik). Minden atom csúcsot hoz létre az
elektronsûrûség-eloszlásban. Az ábrán
az egymáshoz kötõdõ atompárokat olyan
vonal kapcsolja össze, amelynek mentén az elektronsûrûség
nagyobb, mint az atomok közötti bármely más vonal
mentén. Ez a megnövekedett elektronsûrûség
tartja össze az atomokat, tehát ennek tulajdonítható
az atomok közötti kötés. Ahhoz, hogy a molekula atomjaira
jutó töltést meghatározzuk, a molekulát
atomokra kell osztanunk, és a teljes elektronsûrûség
megfelelõ hányadát kell az atomokhoz rendelnünk.
Az interatomos felületek meghatározására Bader
dolgozott ki módszert az elektronsûrûség-eloszlás
topológiája alapján; ez az "atomok és molekulák"
nevû módszer (9). A 3. ábrán, amely a háromdimenziós
elektronsûrûség-eloszlás kétdimenziós
metszete, láthatók azok a vonalak, amelyek mentén
ezek az interatomos felületek metszik a molekula síkját.
Bár itt nem tárgyalhatjuk ezeknek a felületeknek (az
ún. zérus fluxusú felületeknek) a meghatározását,
láthatjuk, hogy az elektronsûrûség-térképen
az atomoknak megfelelõ csúcsok közötti völgyekben
futnak, és áthaladnak az egymással összekötött
atompárok közötti nyeregponton (a legkisebb elektronsûrûségû
ponton). Az interatomos felületekkel definiált "atomok" tulajdonságai
teljesen meghatározhatók kvantummechanikai módszerekkel,
és additívak olyan értelemben, hogy az egyes tulajdonságok
értékei együtt kiadják a molekulára
vonatkozó értéket. Az 1. táblázatban
szereplõ töltések az elektronsûrûség
atomokra számított integráljából származnak;
az atomokat interatomos felületek definiálták. Más
módszereket is javasolnak az atomi töltések meghatározására,
de ezek vagy teljesen empirikusak, vagy minden fizikai alapot nélkülöznek,
mint például Allen módszere (10), vagy a molekulapályákon
alapulnak. Míg a molekula teljes elektronsûrûség-eloszlása
a molekula valódi tulajdonsága, amely röntgendiffrakcióval
meghatározható, a molekulapályák matematikai
függvények, amelyek nem határozhatók meg kísérleti
úton, és némiképp önkényesek, mert
ugyannak a molekulának a leírására különbözõ
pályákból összeállított (pl. lokalizált
és delokalizált) rendszerek használhatók. Ezért
az így kapott töltések nem tekintehtõk olyan
megalapozottnak, mint az "atomok és molekulák" módszerével
meghatározott töltések.
Összefoglalás
A BF3 és a SiF4 molekulák sokkal
ionosabbak, mint eddig általánosan feltételezték.
A teljesen ionos modell jobban leírja a kötést,
mint a teljesen kovalens modell, és egyszerû magyarázatot
ad a kötéshosszakra és kötési energiákra.
A közhiedelemmel ellentétben erõsen ionos jellegû
molekulák is létezhetnek gázfázisban, szobahõmérsékleten.
Azért nem kondenzálódnak ionos szilárd anyaggá,
mert az atomok mérete korlátozza az elérhetõ
maximális koordinációs számot.
Irodalom
1. Gillespie, R. J.; Johnson, S. A.; Tang, T-H.; Robinson, E. A. Inorg.
Chem. 1997, 36, 3022.
2. Shannon, R. D. Aera Crystallog. 1976, A32, 751.
3. Lásd pl., Wells, A. E. Structural Inorganic Chemistry; 4th
ed.; Clarendon: Oxford, 1990; Chapter 3.
4. Pauling L. The Nature of the Chemical Bond, 3rd ed.; Cornell Universiry
Press: Ithaca, NY, 1960; p 514.
5. Wells, A. E. Structural Inorganic Chemistry; 4th ed.; Clarendon:
Oxford, 1990; p 371.
6. Wells, A. E. Structural lnorganic Chemistry; 4th ed.; Clarendon:
Oxford, 1990; p 360.
7. Pauling L. The Nature of the Chemical Bvnd, 3rd ed.; Cornell Universiry
Press: Ithaca, NY 1960; p 224.
8. Huheey, J. E:; Keiter,. E: A.; Keiter, R L: Inorganic Chemistry,
4th ed.; Haiper Collins: New York, 1993.
9. Bader, R. E. W. Atoms in Molecules: A Quantum Theory; Clarendon:
Oxford, 1990.
10. Allen, L. C. J. Am. Chem. Soc. 1989, 111, 9115.
* Az American Chemical Society 1996. évi, New Orelans-i, 211. konferenciáján, a "Text Book Errors" szimpozionon elhangzott elõadás.
2. táblázat. BFn csoportokat tartalmazó molekulák geometriai adatai
| Molekula | B–F,
pm |
< FBF,
fok |
F---F,
pm |
| F2B–F | 130,7 | 120,0 | 226 |
| F2B–OH | 132,3 (10) | 118,0 (10) | 227 |
| F2B–NH2 | 132,5 (12) | 117,9 (7) | 227 |
| F2B–CH3 | 131.5 (5) | 116,8 (5) | 224 |
| F2B–CCH | 132,3 (5) | 116,5 (10) | 225 |
| F2B–Cl | 131,5 (5) | 118,1 (5) | 226 |
| F2B–H | 131,1 (5) | 118,3 (10) | 225 |
| F2B–BF2 | 131,7 (2) | 117,2 (3) | 225 |
| F2B–SiF3 | 131,2 (5) | 118,5 (5) | 226 |
| F3B–F– | 138,6 (4) | 109,4 (4) | 226 |
| F3B–OMe2 | 132,5 (3) | 117 (1) | 226 |
| F3B–O(H)CH3 | 137,0 | 112,0 | 227 |
| F3B–NMe3 | 135,4 (6) | 113,1 (9) | 226 |
| F3B–NCH | 135,6 | 113,0 | 226 |
| F3B–NC2H3 | 134,7 (6) | 113,0 (5) | 225 |
| F3B–CH3– | 142,4 (5) | 105,4 (4) | 227 |
| F3B–CF3– | 139,1 (5) | 109,9 (5) | 228 |
| F3B–PH3 | 137,2 (2) | 112,1 (4) | 228 |
| Átlag: | 226±1 |
[Vissza a szöveghez]