Avagy miért nem kerülnek be a relativisztikus hatások a tankönyvekbe?
A fordítás Lars J. Norrby írása alapján készült (Why Is Mercury Liquid? Or, Why Do Relativistic Effects Not Get into Chemistry Textbooks?, Journal of Chemical Education, 1991. 68. k., 2. sz., 110–113. o.), a JCE engedélyével. A Journal of Chemical Education lapjai a http://jchemed.chem.wisc.edu/ címen érhetõk el.
Már az ókorban is tudták, hogy a higany szobahõmérsékleten
folyékony. Erre utal a görög eredetû hydrargyrum
("vizes ezüst") név (innen származik a Hg vegyjel) és
a latin argentum vivum ("eleven ezüst") kifejezés, amely
a német Quecksilber és az angol quicksilver
névben él tovább. A másik angol név,
a mercury és a francia mercure Mercuriusra, az istenek
gyors lábú hírvivõjére utal.*
Az alkimisták nagyon jól ismerték a higanyt – különösen
fontosnak tartották, hogy az aranyat oldja. Az amalgamálás
és az utána következõ hõbontás
már Kr. e. 500 táján is a nemesfémek elõállítására
szolgált a Földközi-tenger vidékén. Valószínûleg
mindannyian ejtettünk már le hõmérõt és
vadásztunk a szétguruló kis cseppek után. Szobahõmérsékleten
a higany tehát folyékony. De miért? Ha megkérdezem
a hallgatókat vagy a kollégákat, azt válaszolják
"hát... mert... olyan alacsony az olvadáspontja". Ugyan!
Számos szervetlen kémiai tankönyvet és "bibliát" megnéztem, köztük a Greenwood–Earnshaw- (1) és a Cotton–Wilkinson-könyvet (2). A Mackay–Mackay-könyv (3) kivételével sehol sem találtam magyarázatot arra, hogy a higany folyékony. Az utóbbi szerzõk a "Relativisztikus hatások" címû részben térnek ki röviden a jelenségre. Cotton és Wilkinson néha említi ugyan a relativisztikus hatásokat, de nem tárgyalja, hogy milyen jelentõsen befolyásolják a kémiai tulajdonságokat. A Journal of Chemical Education ugyanakkor zavarba ejtõen sok cikket közöl errõl és a rokon problémákról (l. Pyykkö (4,5) és Javasolt irodalom). Ezek után felvetõdik a kérdés: miért nem került be ez a tudás a legfontosabb tankönyvekbe?
A következõkben összevetjük a kísérleti
adatokat és az elméleti számításokat,
majd a higanyban kialakuló kémiai kötéseket tárgyaljuk
abban a reményben, hogy némi fényt derítsünk
a szervetlen kémia néhány klasszikus kérdésére.
A higany és az arany
A két elem összehasonlítása nagyon érdekes,
hiszen az arany és a higany "közvetlen szomszédok" a
periódusos rendszerben, tulajdonságaik mégis eltérnek
egymástól. Olvadáspontjaik például –
az aranyé 1064 oC, a higanyé –39 oC
– jobban különböznek, mint az összes többi szomszédos
pár olvadáspontja (a Li–Be kivételével, ahol
a különbség szintén 1100 oC körüli,
de ennek más oka van). Sûrûségeik, az aranyé
19,32, a higanyé 13,53 gcm–3, szintén jobban eltérnek,
mint más elemek esetében. Olvadási entalpiák
igen különbözõek; Au: 12,8, Hg: 2,30 kJmol–1.
Az olvadási entrópiák azonban hasonlóak; Au:
9,29, Hg: 9,81 JK–1mol–1, ami azt mutatja, hogy a
Hg termodinamikai adatai "rendben vannak", hiszen egybehangzóan
arra utalnak, hogy a kötõerõk sokkal gyengébbek
a higanyban, mint az aranyban. Az adatok azt támasztják alá,
amit már tudunk, de nem magyarázzák meg, miért
folyékony a higany szobahõmérsékleten.
Az arany és a higany elektromos tulajdonságai igen különbözõek. Az arany kiváló vezetõ; vezetõképessége 426 kSm–1, a higanyé csak 10,4 kS m–1. (Az itt szereplõ adatok a Greenwood–Earnshaw-könyvbõl (1) származnak, ha nem jelöljük külön a forrást.)
A szerkezeteket összevetve megjegyezzük, hogy a Cu, Ag és Au köbös, a Zn és Cd (kissé torzított) hexagonális, szoros illeszkedésû kristályokat képez. A Hg azonban romboéderesen torzult, és a Hg–Hg távolság a nem egészen szoros illeszkedésû síkokban kb. 16%-kal nagyobb "a kelleténél". Ismét azt látjuk, hogy a higanyban a fém–fém kötés gyengébb "az elvártnál".
Bár az arany és a higany elektronszerkezete nagyon hasonló,
79Au(g):54Xe|4f14,5d10,6s1
80Hg(g):54Xe|4f14,5d10,6s2
számíthatunk rá, hogy ez a kis különbség okozhatja a meglepõen eltérõ tulajdonságokat. De hogyan?
Anomáliák
A ritkaföldfémek utáni elemeket nézve számos
váratlan periodikus tulajdonságot találunk. Jól
ismert példa a Hf és a Zr meglepõ hasonlósága.
Ezt általában a lantanidakontrakcióval magyarázzák,
amelyet a 4f héj betöltõdése okoz. A 4f elektronok
nem árnyékolják olyan jól a magtöltést,
mint az s, p vagy akár a d elektronok. Ez egyre nagyobb effektív
magtöltéshez és ennek megfelelõen az elektronfelhõ
összehúzódásához vezet. Valószínûleg
jórészt ennek köszönhetõ, hogy a 71Lu3+
körülbelül 0,03 Ã-mel kisebb, mint a 39Y3+,
noha a lutéciumionban 32-vel több elektron van. Ugyancsak a
lantanidakontrakcióval magyarázzák az ezüst és
az arany, illetve a kadmium és a higany azonos ionsugarát.
Miért aranyszínû az arany? Miért nem ezüstszínû? Miért az arany a legnagyobb elektronaffinitású elem a valóban elektronegatív elemeket leszámítva? Az arany elektronaffinitása –223 kJmol–1; nagyobb, mint a kéné és majdnem akkora, mint a jódé. Minek tulajdonítható, hogy a Tl a +1-es, az Pb a +2-es, a Bi a +3-as oxidációs állapotban stabil, míg rokonaik rendre a +3-as, +4-es és a +5-ös állapotban stabilak?
A lantanidakontrakció elve – bármennyire hasznos – nem magyaráz meg minden anomáliát. Elõfordul, hogy az "iners 6s2 pár"-ra hivatkoznak, amelyet Sidgwick vezetett be 1933-ban (l. pl. a klasszikus Phillips–Williams-könyvet (6)). Ez utóbbi elgondolás sem magyarázza azonban meg, miért folyékony a higany, és az Pb(II) miért stabilabb az Pb(IV)-nél. Ezeknek a jelenségeknek az értelmezéséhez a relativitáselméletet kell segítségül hívnunk.
Relativisztikus hatások
Einstein speciális relativitáselmélete szerint
minden mozgó tárgy tömege nõ a sebesség
függvényében:
![]()
Bohr kiszámította, hogy a hidrogénatomban az 1s elektron sebessége alapállapotban a fénysebesség 1/137-e, ha az elektron a Bohr-sugár távolságában kering. Ez a sebesség olyan kicsi, hogy a relativisztikus tömeg csak a nyugalmi tömeg 1,00003-szorosa. (Sommerfeld a kis relativisztikus hatásokat is figyelembe vette, amikor a Bohr-modellt finomítva elliptikus pályákat vezetett be.) Egy hidrogénnél nehezebb atomban egy 1s elektron várható átlagos radiális sebessége
![]()
Ha a 80Hg-t tekintjük, (80/137)·c=0,58c, vagyis a várható átlagos radiális sebesség a fénysebesség 58%-a, s a relativisztikus tömeg a nyugalmi tömeg 1,23-szorosa lesz. Ez azt jelenti, hogy a Bohr-sugár 23%-kal csökken, mert az elektron tömege a nevezõben szerepel. Tehát az arany és a higany 1s pályái jelentõsen összehúzódnak. Miután a pályának ortogonálisnak kell lenniük egymásra, csaknem azonos nagyságú kontrakció alakul ki a 2s, 3s, 4s, 5s, 6s és 7s pályák esetében is.
Nézzük most a kvantummechanikai hatásokat. Az elektronspint két holland fizikus, Uhlenbeck és Goudsmit "találta fel" 1925-ben a hidrogénspektrum finomszerkezetének értelmezésére. Az elmélet bizonyítékaként az 1922-ben elvégzett Stern–Gerlach-kísérletet tekintették (az elpárologtatott ezüstatomokból álló sugár kettévált az inhomogén külsõ mágneses tér hatására). Talán érdekes, hogy Pauli, aki 1925 elején bevezette a negyedik kvantumszámot, nem értett egyet azzal, hogy Uhlenbeck és Goudsmit az elektron természetébõl eredõ mozgásnak tekintette a spint. A kvantummechanika és a relativitáselmélet szintézisét Dirac teremtette meg 1928-ban. Õ mutatta ki, hogy a spin–pálya csatolás relativisztikus hatás, minden elektronnak impulzusmomentuma van és nincs különbség a "pálya" és a "spin" impulzusmomentum között. Az impulzusmomentum kvantumszám, j egyetlen mennyiséget jelöl. Az s pályát s1/2 jellemzi. Az "elektronspin" spektroszkópiai mérésekben ez az impulzusmomentum játszik szerepet. A Dirac-elméletbõl az is következik, hogy a px, py és pz pályák nagyon különböznek szokásos felfogásunktól. A p1/2-del és a p3/2-del jellemzett pályák csoportjába sorolhatók, s mindkét típushoz a j kvantumszám rendelhetõ. A p1/2 gömbszimmetrikus, és a fánk alakú p3/2 pályánál kisebb energiájú. Dirac szerint a pályaenergiák relativisztikus felhasadása magyarázza a spin–pálya csatolási energiát. Ez a nehéz elemek, például az ólom esetében 2 eV (vagy közel 200 kJ mol–1) is lehet.
Végsõ soron három relativisztikus hatásról
beszélhetünk:
az s1/2 és a p1/2 pálya jelentõsen,
a p3/2 kisebb mértékben húzódik
össze;
ennek hatására a d és f pályák –
az s és p pályákhoz képest – kiterjednek;
a spin–pálya csatolás a p, d és f pályaenergiák
relativisztikus felhasadása, az effektus a nehezebb elemek esetében
nagy.
Ezeknek a hatásoknak az összessége igen fontossá válik az arany és a higany esetében, mert az 5d5/2 és a 6s1/2 pályák közötti energiakülönbséget csökkenti. Legalább még egy relativisztikus hatást figyelembe kell venni, a Darwin-járulékot, amely az elektron rezgõmozgását veszi számításba (ez az atommag közelében jelentõs). Hatására az s elektron energiája megnõ, az s pályák tágulnak, ami csökkenti a kontrakciót.
Relativisztikus számítások
Az arany és más nehézfémek relativisztikus
energia-sávszerkezetét többféle módon
is kiszámolták (4, 5, 7, 8). Ezek bemutatása nem könnyû
a jelen cikk keretei között. A számunkra legfontosabb
eredményeket az 1. ábra illusztrálja az AgH(g) és
az AuH(g) molekulák esetében (9, 10). Az ezüst 4d és
5s pályáinak, valamint az arany 5d és 6s pályáinak
különbsége igen eltérõ, bár nem relativisztikus
megfelelõik hasonlóak. A gáz halmazállapotú
szabad aranyatom, az AuH(g) molekula és a kristályos szilárd
anyag természetesen különbözik egymástól,
de a relativisztikus hatások legfontosabb jellemzõi hasonlóak
(8, 11). Schwerdtfeger és munkatársai az arany kémiájában
megmutatkozó relativisztikus hatásokról írtak
kitûnõ dolgozatokat (12, 13). Takeuchi és munkatársainak
számításai szerint (14) relativisztikus effektusnak
tulajdonítható, hogy az arany kohéziós energiája
nagyobb az ezüsténél.
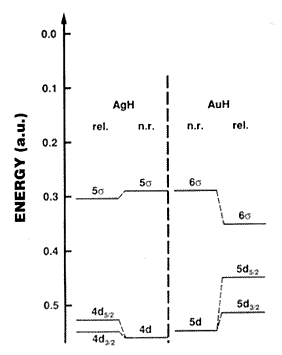
1. ábra. Az AgH(g) és az AuH(g) kétatomos molekula pályaenergiái a relativisztikus és a nem relativisztikus számítások alapján. (Az energia atomi egységekben (a.u.) van feltüntetve,1 a.u. = 27,212 eV = 2625,5 kJ mol–1.) Tehát a függõleges tengelyen DE » 260 kJ felel meg egy osztásköznek. Pyykkö (9) nyomán.
Az arannyal és más nehézfémekkel végzett röntgen-fotoelektron sepktroszkópiai (ESCA) vizsgálatok azt mutatják, hogy a relativisztikus számítások eredményei jobban egyeznek a kísérlettel, mint a nem relativisztikus eredmények. A mérések és a számítások egyaránt arra utalnak, hogy a szilárd aranyban a fém-fém kötéseket a 6s és az 5d elektronok hozzák létre szinte a 6p elektronok nélkül.
Említésre méltó, hogy a relativiszitikus effektusok nem egyenletesen változnak a rendszám függvényében. A 79Au-nál tûnnek a legnagyobbnak. A szabad Au(g) atom 6s pályájának relativisztikus kontrakciója, amely a tömeg sebességfüggésébõl származik kb. 16% (8). Ehhez hozzáadódik a lantanidakontrakció (amelyben szintén szerepet játszanak relativisztikus hatások), továbbá az 5d pályák hasonló összehúzódása. A szilárd aranyban a 6s elektron 2,8 eV (270 kJ mol–1) teljes stabilizációs energiája 2/3 részben származik relativisztikus hatásokból és 1/3 részben lantanidakontrakcióból (15, 16). Ezeknek a hatásoknak eredménye általában nehezen jósolható meg.
Az ezüst és az arany
Most már számos különbséget megmagyarázhatunk.
Az arany színe annak köszönhetõ, hogy a fém
kék fényt elnyeli és az 5d elektronok a 6s szintre,
pontosabban a Fermi-szintre gerjesztõdnek, amely a vezetési
sáv tetején helyezkedik el. Az ezüst energiasávjai
azonban távolabb vannak, ezért az elem UV-fényt nyel
el, és színtelennek látszik. Az arany elsõ
ionizációs energiája kissé nagyobb, mint az
ezüsté, míg a második és a harmadik ionizációs
energia az ezüst esetében nagyobb. Ezért gyakrabban
találkozunk Ag(I)-, mint Au(I)-vegyülettel, de az Au(III)-vegyületek
gyakoribbak az Ag(III)-nál. Ezenkívül az arany kötései
jobban megközelítik a kovalens jelleget a komplexekben; ez
a d–s hibrid pályáknak köszönhetõ, amelyek
energetikailag kedvezõbbek, mint az ezüstben. Az 1. ábra
mindezzel kvalitatív egyezést mutat (17).
Az elektronaffinitás
Az arany nagy elektronaffinitását a következõképpen
magyarázhatjuk. A 6s pálya energiája olyan alacsony,
hogy egy külsõ elektron könnyen a pályára
ugorhat. A relativisztikus hatások az arany elektronaffinitását
65%-kal növelhetik meg (18). Ugyancsak relativisztikus hatások
magyarázzák az Au2(g) molekula meglepõ
stabilitását. A molekula disszociációs energiája
(221 kJmol–1) nagyobb, mint a I2(g)-é (151
kJmol–1) és alig kisebb, mint a Cl2(g)-é
(243 kJmol–1).
Intermetallikus vegyületek
A CsAu nem fémesen vezetõ ötvözet, hanem vörös,
átlátszó, CsCl-szerkezetben kristályosodó
félvezetõ. Ez szintén arra utal, hogy az Au 6s pályájára
könyen beléphet még egy elektron. A kísérleti
adatok a 2.ábrán láthatók (19). A CsAu elektronszerkezétnek
számítása alátámasztja (19), hogy a
félvezetõ jelleg relativisztikus hatásnak tudható
be. Az arany itt nem különbözik teljesen a jódtól,
ezért "pszeudohalogénnek" is nevezik.
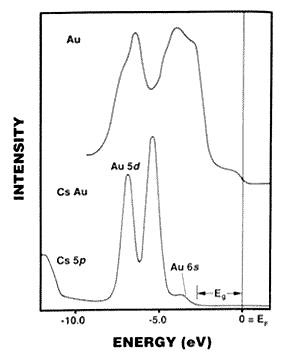
2. ábra. Az arany és a félvezetõ CsAu ESCA- (XPS-) spektruma. Az eV-ban megadott energiaértékek az EF Fermi-szintre vonatkoznak. Az aranyban a 6s és az 5d sáv összeolvad (hibridizálódik) és a Fermi-szintig húzódik. A CsAu-ban az elektronsûrûség a Cs-ról az Au-ra tolódik át. A 6s sáv most lokalizált, nem keveredik az 5d sávval, és a Fermi-szinttõl Eg » 2,6 eV energiasáv választja el. Az Au 5d energiáinak kb. 1,5 eV-os relativisztikus felhasadása jól érzékelhetõ a CsAu esetén. Wertheim (19) nyomán.
Miért folyékony a higany?
A válaszhoz a gázfázist és a Hg(I)-et kell
megvizsgálnunk. A higany nem képez kovalens egyszeres kötést,
mint az Au2. Az Au2-vel azonos számú
elektront tartalmazó H22+ azonban nagyon stabil;
vizes oldatban és szilárd vegyületekben is elõfordul.
A számítások szerint (21) a relativisztikus effektusok
mind az Au2-ben, mind a H22+-ben 16%-kal
csökkentik a kötéshosszakat, s így a kötések
rövidebbek, mint az analóg réz- és kadmiumvegyületekben.
Ha párhuzamot akarunk vonni, azt mondhatjuk, hogy olyan különbség
van a stabil Au2(g) molekulát alkotó arany és
a higany között, amely a gázfázisban a fémek
közül egyedül létezik szinte kizárólag
monomerként, Hg(g) alakban, mint a H2(g) és a
szigorúan monomer He(g) között. A szokásos magyarázat
szerint azért nincs He2(g), mert a harmadik és
negyedik vegyértékelektron a nemkötõ 1s*
pályát töltené be, tehát elbontaná
a kétatomos molekulát. A Hg-ban a relativisztikusan összehúzódott
6 s pálya be van töltve, ezért a két 6s elektron
kis járulékot ad a fém-fém kötéshez.
Éppen az ellenkezõje igaz az arany esetében. Tehát
a higanyban a Hg–Hg-kötés elsõsorban van der Waals-erõknek
(22) és talán a 6p pályák gyenge kölcsönhatásának
köszönhetõ, ezért gyenge.
Most arra is magyarázatot kapunk, hogy miért sokkal rosszabb vezetõ a higany az aranynál: a két 6s elektron igen lokalizált, s csak kis járulékot szolgáltat a vezetési sávhoz. Ennek az analógiának az alapján a higanyt pszeudonemesgáznak is nevezhetnénk.
Amalgámozás
Miért oldja a folyékony higany az aranyat és miért
képez amalgámot? Milyen a kémiai kötés
az amalgámban? Miért alkot a higany amalgámot a rézzel,
az arannyal, az ezüsttel és az alkálifémekkel?
Miért reagál az ammóniumgyökkel? Miért
reagál alig vagy miért nem reagál az átmeneti
fémek többségével? Már említettük,
hogy az arany hevítéssel kinyerhetõ az amalgámból,
tehát a Hg és az Au közötti kötés nem
erõs. Tekintsünk egy képzeletbeli gázalakú
molekulát, a HgAu(g)-t. A spektroszkópiai úton elemzett
He2+-hoz hasonlóan háromelektronos
kötése lenne (Hg···Au), két elektron
a kötõ 6s, egy a nemkötõ
6s* pályán helyezkedne el. Ez
a kötés gyengébb lenne, mint az Au2(g) egyszeres
kötése, de erõsebb, mint a Hg-atomok közötti
kötés. Az ezüst és az arany atomonként egy
elektront ad az amalgámkötésbe. Ugyanez érvényes
az alkálifémekre. A legtöbb átmeneti fém
azért reagál gyengén a higannyal, mert atomonként
két s elektronnal járul hozzá a kötéshez,
de ekkor a tiszta higany esetéhez jutunk vissza: csak nagyon gyenge
kötések alakulhatnak ki. Úgy tûnik, hogy ha az
ötvözõ fém egy elektront ad atomonként,
jó amalgám képzõdik.
Hangsúlyozni kell, hogy a fentieket nem támasztják alá egyértelmû számítások. A szilárd higany kötési sávjának relativisztikus számításához rendszerint fel kell tételezni, hogy a fém kristályszerkezete vagy szoros illeszkedésû köbös, vagy köbös tércentrált. A kristályos higany romboéderes torzulása miatt a köbös tércentrált elrendezés rossz közelítés lenne. Az Au–Hg biner rendszerben nem találtak olyan intermetallikus fázist, amely több higanyt tartalmazna, mint az Au2Hg. Ennek a sztöchiometrikus vegyületnek hexagonális kristályszerkezete van, amely 122 oC-on olvad inkongruensen. Az arany a szilárd higanyban szinte oldhatatlan (23). A nagy higanytartalmú amalgámok ezért többé-kevésbé az Au2Hg és a Hg jól kristályosodó, kétfázisú keverékei. Ugyancsak hasznosak lennének a folyékony higanyon végzett relativisztikus számítások, amelyek a folyadék szerkezetét (a nyolc közeli szomszédból álló egységeket) is figyelembe vennék.
Az iners 6s2 pár
Utolsó példaként hasonlítsuk össze
a 81Tl-t és a 49In-t. Bár a Tl+-ion
sugara nagyobb (1,50 Ã), mint az In+-é (1,40 Ã),
a Tl+ nagyobb energia árán juthat a +1-es oxidációs
állapotból a +3-asba, mint az In+. A második
és a harmadik ionizációs energia összege a Tl
esetében 4848 kJmol–1, az In-nál 4524
kJmol–1, a különbség kb. 7%. A Tl+-ionban
ugyanannyi elektron van, mint a Hg-ban. A Tl3+-ion képzõdésekor
a két elektron eltávolításához szükséges
energiatöbblet nyilvánvalóan a 6s pálya relativisztikus
kontrakciójából származik. A tankönyvekben
gyakran szereplõ "iners 6s2 pár"-ról mégsem
írják, hogy relativisztikus effektus eredménye.
Legalább 15 éve ismert, hogy a relativisztikus hatások befolyásolják a nehéz elemek tulajdonságait. Ezt a tudást a kutatók felhasználják munkájuk során (24–26). Itt az ideje, hogy az egyetemi kémiatanításban is szó essen róla.
Javasolt irodalom
Pitzer, K. S. Acc. Chem. Res. 1979, 12, 271.
Pyykkö, P.; Desclaux, J. P. Acc. Chem. Res. 1979, 12, 276.
Malli, G. L., Ed. Relativistic Effects in Atoms, Molecules, and Solids; Plenum: New York, 1983.
Christensen, N. E. Int. J. Quant. Chem. 1984, 25, 223.
Christiansen, P. A.; Ermler, W. C.; Pitzer, K. S. Ann. Rev. Phys. Chem. 1985, 36, 407.
Pyykkö, P. Chem. Rev. 1988, 88, 563.
A Journal of Chemical Education cikkei
Powell, R. E. J. Chem. Educ. 1968, 95, 558.
Szabo, A. J. Chem. Educ. 1969, 46, 678.
McKelvey, D. R. J. Chem. Educ. 1983, 60, 112.
Banna, M. S. J. Chem. Educ. 1985, 62, 197.
Mason, J. J. Chem. Educ. 1988, 65, 17.
Idézett irodalom
1. Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements; Pergamon:
Oxford, 1984; p 1395.
2. Cotton, F. A.; Wilkinson, G. Advanced Inorganic Chemistry, 5th ed.;
Wiley: New York, 1988; p 597.
3. Mackay, K: M.; Mackay; R. A. Introduction to Modern Inorganic Chemistry,
4th ed.; Blackie: Glasgow and London; 1989; p 292.
4. Pyykkö, P. Relativistic Theory of Atoms and Molecules, A Bibiography
1916-1985; Springer: Berlin;.1986. Több mint 3100 hivatkozást
tartalmaz!
5. Pyykkö, P. Chem. Rev: 1988; 88, 563.
6. Phillips, C. S. G.; Williams, R. J. P. Inorganic Chemistry; Oxford
University: New York, 1966; Vol. 2, Metals.
7. Takeda, T. J: Phys. F.: Metal Phys. 1980, 10, 1135.
8. Christensen; N. E. Int. J. Quant. Chem. 1984; 25, 233.
9. Pyykkö, P. Adv. Quant. Chem. 1978. 11, 353.
10. Pyykkö, P; Desclaux; J. P. Acc. Chem. Res. 1979, 12, 276.
11. Koelling; D. D.; MacDonald, A. H. In Relativistic Effeets in Atoms,
Molecules, and Solids; Malli,.G. L.; Ed.; Plenum: New York, 1983; p 227.
12. Schwerdtfeger; P., Dolg, M.; Schwarz, W. H. E.; Bowmaker, G. A.;
Boyd, P. D. W. J. Chem. Phys. 1989, 91,1762.
13. Schwerdtfeger, P. J. Am. Chem. Soc. 1989, 111, 7261.
14. Takeuchi, N.; Chan, C. T.; Ho, K. M. Phys. Rev. B. 1989, 40, 1565.
15. Bagus, P. S.; Lee, Y. S.; Pitzer, K. S.. Chem. Phys. Lett. 1975,
33, 408.
16. Christiarisen, P. A.; Ermler, W. C.; Pitzer, K. S. Ann. Rev. Phys.
Chem. 1985, 36, 407.
17. Desclaux, J. P.; Pyykkö, P. Chem. Phys. Lett. 1976, 300.
18. Cole, L. A.; Perdew, J. P. Phys. Rev. A 1982, 25, 1265.
19. Wertheim, G. K. In Solid State Chemistry Techniques; Cheetham,
A. K.; Day, P., Eds.; Clarendon: Oxford, 1987, Chapter 3.
20. Christensen, N. E.; Kollar, J. Sol. State Comm. 1983, 46, 727.
21. Ziegler, T.; Snijders, J. G.; Baerends, E. J. J. Chem. Phys. 1981,
74, 1271.
22. Pyper, N. C.; Grant, I. P.; Gerber, R. B. Chem. Phys. Lett. 1977,
99. 479.
23. Rolfe, C.; Hume-Rothery, W. J. Less Comm. Met. 1967, 13, 1.
24. Gillespie, R. J.; Granger, P., Morgan, K. R.; Schrobilgen, G. J.
Inorg. Chem. 1984, 23, 88 7.
25. Burns, R. C.; Devereaux, L. A., Granger, P.; Schrobilgen, G. J.
Inorg. Chem. 1985, 24, 2615.
26. Björgvinsson; M.; Sawyer, J. F.; Schrobilgen, G. J. Inorg.
Chem. 1987, 26, 741.